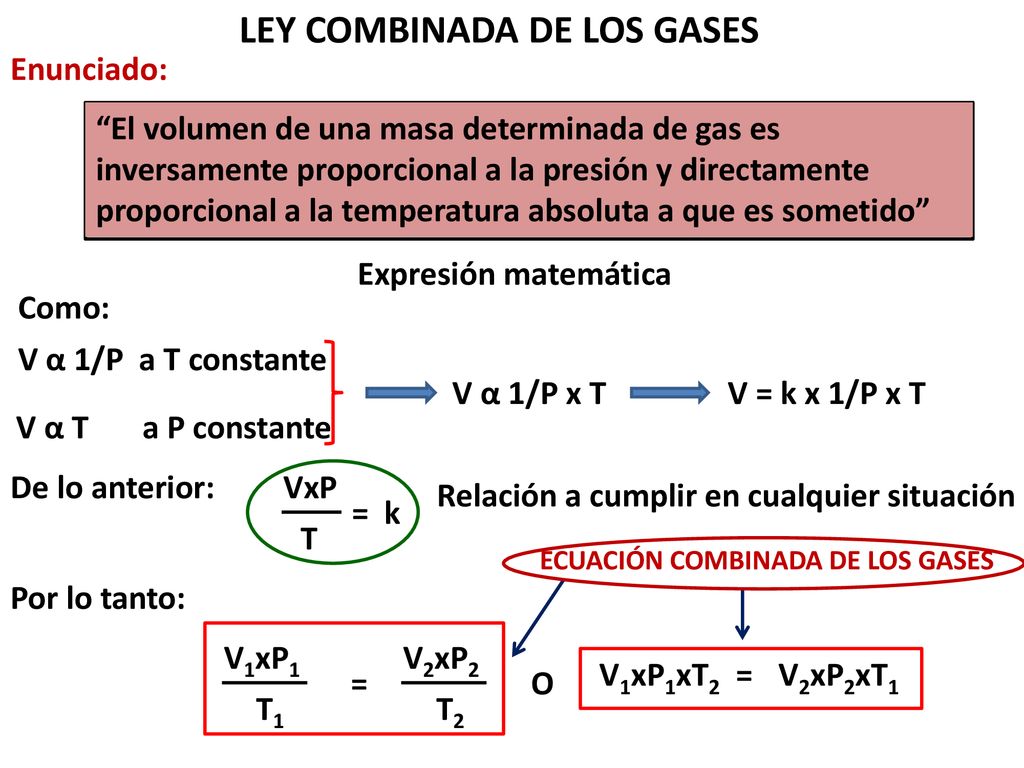
| Ley | Variables | Relación | Constantes | Ecuación |
|---|---|---|---|---|
| Boyle |
Presión
Volumen
| Inversa |
Moles
Temperatura
| |
| Charles |
Volumen
Temperatura
| Directa |
Presión
| |
| Gay-Lussac |
Temperatura
Presión
| Directa |
Moles
Volumen
| |
| Avogadro |
Volumen
Moles
| Directa |
Presión
Temperatura
|
Despejar cada una de las variables de las ecuaciones que representan las leyes combinadas de los gases.
https://www.youtube.com/watch?v=5pXAxNyTJAY
Actividad 3: observa los experimentos y trata de involucrar cada una de las variables y las relaciones inmersas en las leyes de Boyle, Charles y Gay-lusaac.
Inspirarte en cada experimento y propone otra forma de explicar una de las leyes, utilizando material reciclado. Puedes grabar video o exponerlo en clase, cuando se reanuden las clases presenciales.
f. Un trozo de dióxido de carbono sublimado (hielo seco) genera una muestra de 0.8 L de CO2 gaseoso a 22ºC y 720 mm Hg ¿Qué volumen tendrá el dióxido de carbono gaseoso a 0o C y 760 mmHg?
g. Una muestra de 4L de nitrógeno se recoge a 1.5 atm y 288 K. Si la presión se incrementa a 2.5 atm y el volumen se reduce a 2L, ¿qué temperatura posee el nitrógeno?
h. Redacta y resuelve 3 ejercicios más.
Actividad 6: resuelve los siguientes ejercicios, tomando en cuenta los siguientes parámetros: extraer los datos, relacionar la fórmula, realizar el respectivo despeje de la variable en cuestión, reemplazar en la fórmula, con sus respectivas unidades, cancelar unidades iguales y dar el resultado con las unidades correspondientes.
b. ¿Cuál es el volumen en mL que ocupa un gas ideal si 0,553 moles se encuentran a una temperatura de 1226,49 K y a una presión de 4932 mmHg ?
c. ¿Cuál es la temperatura en K de un gas ideal, si 0,405 moles ocupan un volumen de 7720 mL a la presión de 790 mmHg ?
d. ¿Cuál es la temperatura en °C de un gas ideal, si 0,746 moles ocupan un volumen de 9890 mL a la presión de 1,41 atm ?
e. ¿Cuál es la temperatura en K de un gas ideal, si 0,322 moles ocupan un volumen de 4.71 litros a la presión de 1201 mmHg ?
f. ¿Cuál es la presión en atm de un gas ideal, si 0,532 moles ocupan un volumen de 4390 mL a la temperatura de 183,93 K ?
g. ¿Cuál es el volumen en mL que ocupa un gas ideal si 0,757 moles se encuentran a una temperatura de 531,51 K y a una presión de 4666 mmHg ?
h. ¿Cuántos moles de un gas ideal hay en un volumen de 4220 mL si la temperatura es 279,35 K y la presión es 1,75 atm ?
i. ¿Cuántos moles de un gas ideal hay en un volumen de 9,37 litros si la temperatura es -43 °C y la presión es 851 mmHg ?
NOTA: se recomienda la realización de las actividades de manera constante, no dejar para última hora. el éxito del aprendizaje depende de apropiar los primeros conceptos, que son pre requisito de los siguientes.
puede realizar los trabajos de manera digital o escritos a mano en el cuaderno, tomar foto y enviarlos al correo: rojashurtadoalbaines@gmail.com
Nombre
del estudiante
|
Grado
|
10 A y B
|
||
Período
|
Primero
|
Asignatura
|
Química
|
|
Docente
|
Alba Inés Rojas Hurtado
|
|||
Competencias
|
|
|||
Aprendizajes
del periodo (el estudiante debe desarrollar los reportados en el boletín)
|
Formulo preguntas específicas sobre una observación, sobre una experiencia o sobre las aplicaciones de teorías científicas. Comparo los modelos que explican el comportamiento de gases ideales y reales.
Uso la tabla periódica para determinar propiedades físicas y químicas de los elementos.
Realizo cálculos cuantitativos en cambios químicos. Me informo sobre avances tecnológicos para discutir y asumir posturas fundamentadas sobre sus implicaciones éticas. Demuestro actitud de interés, respecto y escucha durante el desarrollo de las clases. |
|||
Descripción de la dificultad
para alcanzar el/los aprendizaje/s
|
Desinterés por el aprendizaje de los conceptos
propuesto, irresponsabilidad en la realización de las tareas propuestas, falta
de trabajo en equipo, deficiencia en las sustentaciones individuales.
|
|||
Identifico beneficios de la ciencia, en general de la química y en particular de la vida cotidiana.
Diferencia los cambios químicos y físicos de la materia.
Adquiere disciplina y constancia en el trabajo.
Es consciente del efecto negativos de los aerosoles, desechos domésticos e industriales en la contaminación del medio ambiente.
Reconoce la importancia de la química a través de la historia
Diferencia los cambios químicos y físicos de la materia
Compara los cambios de la materia en sus diferentes estados.
Clasifica correctamente la materia en sustancias puras y mezclas.
Clasifico los compuestos tomando como base la perdida, ganancia o compartición de electrones.
 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PROPIEDADES DE LA MATERIA
LA MATERIA
Es Todo aquello que tiene masa y ocupa un lugar en el espacio, es cuantificable, es decir, que se puede medir. Todo cuanto podemos imaginar, desde un libro, un auto, el computador y hasta la silla en que nos sentamos y el agua que bebemos, o incluso algo intangible como el aire que respiramos, está hecho de materia.Los planetas del Universo, los seres vivos como los insectos y los objetos inanimados como las rocas, están también hechos de materia.
Actividad 1
1.Identifique y
describa una problemática de su comunidad en la que se pueda
aplicar el conocimiento o los avances de la química como alternativa de solución. Explique además, cómo cree que la química podría aportar en su
solución.
2.Tomando en cuenta,
las propiedades medibles de la materia, selecciónalas, indica con que instrumento se pueden
medir, midelas y registra los datos en el
siguiente cuadro:
PROPIEDADES DE LA MATERIA
Las propiedades de la materia se clasifican en dos grandes grupos: generales o extrínsecas y especificas o intrínsecas.
Propiedades Generales: son las propiedades que presenta todo cuerpo material sin excepción y al margen de su estado físico, así tenemos:
Propiedades especificas: son aquellos que no dependen de la cantidad de materia, los más importantes son:

Actividad 2
a. tomando en cuenta los conceptos del mapa, redacta un texto que contenga las propiedad de la materia, con sus respectivos ejemplos.
b. Realiza un resumen del video, saca un listado de las propiedades de la materia, que allí se relacionan y consulta corta definición para cada una.
Actividad 3 a. Resuelve el crucigrama:
b. Existen propiedades de la
materia que no se pueden medir. Cuáles son?. Por qué crees que no se pueden
medir?.
c. Cómo crees que surgió la medición?. En la
cotidianidad de la casa que se mide?. Cómo se mide?
ESTADOS DE LA MATERIA
observo el video con atención
Los sólidos
En los sólidos, las partículas están unidas por fuerzas de atracción muy grandes, por lo que se mantienen fijas en su lugar; solo vibran unas al lado de otras.
Propiedades
- Tienen forma y volumen constantes.
- Se caracterizan por la rigidez y regularidad de sus estructuras. - No se pueden comprimir, pues no es posible reducir su volumen presionándolos. - Se dilatan: aumentan su volumen cuando se calientan, y se contraen: disminuyen su volumen cuando se enfrían.
Los líquidos
las partículas están unidas, pero las fuerzas de atracción son más débiles que en los sólidos, de modo que las partículas se mueven y chocan entre sí, vibrando y deslizándose unas sobre otras.
Propiedades
- No tienen forma fija pero sí volumen.
- La variabilidad de forma y el presentar unas propiedades muy específicas son características de los líquidos.
- Los líquidos adoptan la forma del recipiente que los contiene.
- Fluyen o se escurren con mucha facilidad si no están contenidos en un recipiente; por eso, al igual que a los gases, se los denomina fluidos.
- Se dilatan y contraen como los sólidos.
Los gases
En los gases, las fuerzas de atracción son casi inexistentes, por lo que las partículas están muy separadas unas de otras y se mueven rápidamente y en cualquier dirección, trasladándose incluso a largas distancias.
Propiedades:
- No tienen forma ni volumen fijos.
- En ellos es muy característica la gran variación de volumen que experimentan al cambiar las condiciones de temperatura y presión. - El gas adopta el tamaño y la forma del lugar que ocupa. - Ocupa todo el espacio dentro del recipiente que lo contiene. - Se pueden comprimir con facilidad, reduciendo su volumen. - Se difunden y tienden a mezclarse con otras sustancias gaseosas, líquidas e, incluso, sólidas. - Se dilatan y contraen como los sólidos y líquidos. Plasma: Existe un cuarto estado de la materia llamado plasma, que se forman bajo temperaturas y presiones extremadamente altas, haciendo que los impactos entre los electrones sean muy violentos, separándose del núcleo y dejando sólo átomos dispersos.
El plasma, es así, una mezcla de núcleos positivos y electrones libres, que tiene la capacidad de conducir electricidad.
Un ejemplo de plasma presente en nuestro universo es el sol. CAMBIOS DE ESTADO
El estado en el cual se encuentra en particular una sustancia depende de dos factores o condiciones que son la temperatura y la presión, por lo tanto si se modifica algunas de estas variables o las dos, la materia puede pasar de un estado a otro.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Salón
|
Casa
|
Ciudad
|
1.
2.
3.
|
Situación
|
Estado inicial
|
Estado final
|
Nombre del cambio de estado
|
Mamá dejó abierto su removedor o quita esmalte. Cuando
nos dimos cuenta, el frasco solo tenía la mitad del
contenido inicial.
|
|||
Cuando mamá cocina carne, el olor llega desde la
cocina hasta mi habitación pero la carne
cruda apenas huele.
|
|||
Las nubes se
forman cuando el vapor de agua que se encuentra en la atmósfera se enfría.
|
|||
El espejo del baño se empaña cuando alguien se ducha con agua caliente.
|
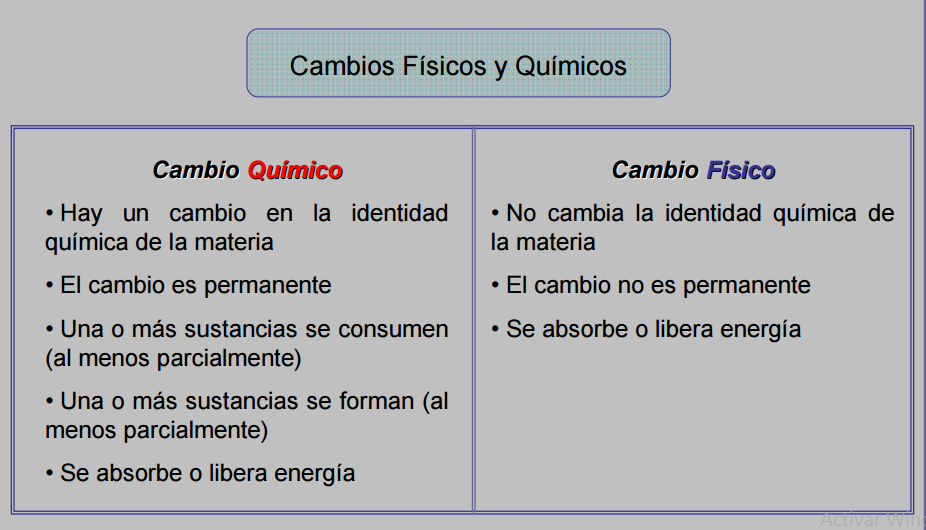
TRANSFORMACIONES DE LA MATERIA

Al añadir azúcar al agua, el azúcar se disuelve totalmente.
Transformaciones Químicas
b. Consulta 3 ejemplos más de cambio físico y 3 de cambio químico
c. Observa la figura donde se relacionan los cambios de estado, define los conceptos que se relacionan e ilustra cada uno con un ejemplo cotidiano.
_________________________________________________________________________
SEGUNDA PARTE DEL TRABAJO DEL SEGUNDO PERIODO
1. ¿Qué tipos de mecanismo existen para formar enlaces químicos?
Instrucciones:
Lee el siguiente texto
Actividad 4
1. observa con mucha atención el video. realiza resumen y extrae cinco ideas fundamentales que te sirvan para resolver los ejercicios propuesto mas adelante
Enlace Covalente
a) H2
|
f ) CO2
|
|
b) Cl2
|
g) H2O
|
|
c) O2
|
h) HNO2
|
|
d) N2
|
i) HCl
|
|
e) F2
|
j) CO
|
Enlaces iónicos
|
Enlaces covalentes
|
-Se da entre cationes y aniones.
-Uno cede electrones y el otro recibe. Son solubles en agua.
-Son sólidos a temperatura ambiente.
-Conducen la electricidad en disolución o fundidos.
-En general, sus puntos de fusión son altos.
|
Se da entre átomos y átomos. Ambos comparten el par electrónico. Este
tipo de enlace se subdivide en :
–Sencillo.
–Doble.
–Triple.
Son gases y líquidos a temperatura ambiente.
Apolares no son solubles en agua, pero sí lo son en
compuestos apolares.
Polares son solubles en compuestos polares. No conducen la corriente eléctrica.
En general, tienen puntos de fusión bajos.
|
Sustancia
|
Soluble en agua
|
No soluble en agua
|
Sal
|
||
Azucar
|
||
6. Observa el laboratorio y extrae cinco conclusiones relacionados con las sustancias ionicas y covalentes.
Materia es todo lo
que ocupa un espacio y tiene masa, forma, peso y volumen, por lo tanto se puede
observar y medir. También se refiere al material, sustancia o producto del que
está hecho una cosa.
Es importante reconocer lo que es la propiedad de la materia, ya que está en todo lo que nos rodea, siendo la materia todo lo que ocupa un lugar en un espacio.
11. Tomando en cuenta el mapa conceptual, construye un escrito donde se
define:
a. El concepto de materia
b. Propiedades de la materia
c. Diferencia entre propiedades generales y específicas
d. Diferencia entre propiedad física y química
e. Ejemplos de propiedades físicas y químicas.
1. 2.De acuerdo al mapa. ¿Qué es una
propiedad organoléptica?
1. 3. Construye un mapa conceptual con las siguientes propiedades
Masa. Volumen, peso, dureza, inercia, divisibilidad, impenetrabilidad, densidad, solubilidad, elasticidad, punto de ebullición, punto de fusión, solidificación.
4. Construye oración con sentido químico con los siguientes conceptos
Oxidación, fermentación, putrefacción, combustión.
1. Completa el cuadro
|
Propiedad |
Tipo de propiedad |
Órgano de los sentidos con que se puede
medir |
Ejemplo |
|
Textura
|
|
|
|
|
Olor
|
|
|
|
|
Color
|
|
|
|
|
Sabor
|
|
|
|
1. 6.Tomando
en cuenta el mapa responder
a.
El
enlace químico es._______________________________________________________________________
b. El enlace químico se clasifica en._____________________________________________________________
c. El
enlace iónico es._____________________________________________________________________________
d. Las diferencias que existen entre los enlaces covalente polar y covalente apolar son.
______________________________________________
e.
El
enlace metálico se caracteriza por.
_______________________________________________________________________________
f.
El
enlace covalente se puede presentar de cuatro formas, estas son.
_____________________________________________________________________________
Aprendizajes a Desarrollar:
-Identifico el desarrollo histórico de la química, como ciencia fundamental en el desarrollo de la humanidad.
-Valoro la labor de los investigadores científicos en los alcances de la sociedad.
-Identifico los descubrimientos químicos que dieron lugar a los diferentes periodos de la humanidad.
-Desarrollo habilidades de interpretación y síntesis en la lectura y la producción de textos.
-Asumo aptitud de responsabilidad en la presentación de trabajos en las fechas estipuladas.
Introducción
La concisión, amenidad y eficacia didáctica características de Isaac Asimov hacen de esta Breve Historia de la química un instrumento inmejorable para todo aquel que esté interesado en aproximarse a esta ciencia. Asimov traza la evolución de este ámbito de conocimiento desde el momento en que el hombre comenzó a efectuar
alteraciones en la naturaleza de las sustancias de una forma intuitiva, hasta la edad moderna, momento en el que, a través de la adquisición progresiva de rigor metodológico y la acotación del terreno de estudio, se va constituyendo plenamente como disciplina científica.
Actividad
1. Realizar lectura del primer y segundo capitulo del libro Breve historia de la Química.
2. Realizar resumen por cada subtítulo del capítulo.
3. Iniciar el llenado del cuadro de línea del tiempo.
Breve Historia de la Química (Isaac Asimov) | |||||
Personajes | Descubrimientos | Aporte a la Ciencia y a la Humanidad |
| ||
|
|
|
| ||
https://docs.google.com/document/d/1Uw9rjVY3W9EAqLB31Lf1B3GFrjVb5VDI2zg9fpZX3qE/edit?usp=sharing
Contacto del docente: Alba Inés Rojas Hurtado
Vía telefónica, lunes a viernes de 9 a 12 de la mañana 3137985605. Correo electrónico: rojashurtadoalbaines@gmail.com
Aprendizajes a Desarrollar:
-Identifico el desarrollo
histórico de la química, como ciencia fundamental en el desarrollo de la
humanidad.
-Identifico los descubrimientos químicos que dieron lugar a los diferentes periodos de la humanidad.
-Desarrollo habilidades de interpretación y síntesis en la lectura y la producción de textos.
-Asumo aptitud de responsabilidad en la presentación de trabajos en las fechas estipuladas
Trabajo a realizar
A. leer los capítulos 3 y 4 del libro Breve Historia de la Química.
Capítulo 3: La transición
Contenido:
1. La medida
2. La ley de Boyle
3. La nueva concepción de los elementos
4. El flogisto
1. La medida
Capítulo 4: Los gases
Contenido:
1. Dióxido de carbono y nitrógeno
2. Hidrógeno y oxígeno
3. El triunfo de la medida
4. La combustión
B. Realizar los resúmenes de cada capítulo, tomando en cuenta cada uno de los subtítulos
c. continuar llenando el cuadro propuesto en la actividad anterior, tomando en cuenta los personajes y los descubrimientos y procesos de la transformación de la materia.
|
Breve Historia de la Química (Isaac Asimov) |
||||
|
Descubrimientos |
Aporte a la Ciencia y a la Humanidad |
|
||
|
|
|
|
||
Tercera entrega Tercer Periodo
Trabajo para 15 días, del 31 de agosto al 14 de septiembre
Aprendizajes a Desarrollar:
-Realizo síntesis y resúmenes de los conceptos
expuestos en cada capítulo del libreo breve Historia de la química.
-Construyo un orden cronológico sobre los
acontecimientos que dieron paso a la constitución de la química como ciencia, a
través de cuadro de síntesis.
-Asumo actitud de responsabilidad en la
presentación de trabajos en las fechas estipuladas.
Actividad
1.
Realizar lectura de los capítulos del 5 al 10, del libro
Breve historia de la Química.
2.
Realizar ensayo de dos páginas, sobre el contenido
de los capítulos relacionados.
3.
Continuar con el llenado del cuadro de línea del
tiempo, resaltando en cada capitulo, los personajes destacados, los descubrimientos y el aporte a la ciencia y humanidad.
ojo, antes de realizar el ensayo, observa el video, para que repases la estructura que deben tener los ensayos.
https://www.youtube.com/watch?v=1_-mE4zS7X4
|
Breve Historia de la
Química (Isaac Asimov) |
|||||
|
Capítulo |
Personajes |
Descubrimientos |
Aporte a la Ciencia
y a la Humanidad |
|
|
|
|
|
|
|
|
|
Cuarta entrega Tercer Periodo
Trabajo del14 28 de septiembre
Actividad
1.
Realizar lectura de
los capítulos 11, 12, 13 y 14 del libro Breve historia de la Química.
2.
Realizar ensayo de dos
páginas, sobre el contenido de los capítulos relacionados.
3.
Continuar con el
llenado del cuadro de línea del tiempo.
4. Consultar y redactar biografía del autor, con los aspectos más relevantes de su vida.
|
Breve Historia de la Química (Isaac Asimov) |
||||
|
Capítulo |
Personajes |
Descubrimientos |
Aporte a la Ciencia y a la Humanidad |
|
|
|
|
|
|
|
PLANES
DE MEJORAMIENTO
De acuerdo
a lo establecido en el decreto 1290 y en el sistema de evaluación institucional
los estudiantes que presenten desempeño bajo en una asignatura deben presentar
un plan de mejoramiento, teniendo en cuenta lo siguiente:
|
Nombre del estudiante |
|
Grado |
10 |
|
|
Período |
3 |
Asignatura |
Química |
|
|
Docente |
Alba Inés Rojas Hurtado |
|||
|
Competencias |
·
Leer comprensivamente textos relacionados
con el desarrollo histórico de la química ·
Escribir con significado resúmenes y
opiniones propias sobre textos históricos relacionados con el desarrollo
histórico de la química. ·
Realizar los trabajos y presentarlos en las
fechas pactadas. |
|||
|
Aprendizajes del periodo (el
estudiante debe desarrollar los reportados en el boletín) |
·
Realizo síntesis y resúmenes de los conceptos expuestos en cada
capítulo del libreo breve Historia de la química. ·
Construyo un orden cronológico sobre los acontecimientos que dieron
paso a la constitución de la química como ciencia, a través de cuadro de
síntesis. ·
Asumo actitud de responsabilidad en la presentación de trabajos en las
fechas estipuladas. |
|||
|
Descripción de la dificultad para alcanzar el/los aprendizajes/s |
Dificultad para realizar las lecturas programadas, realizar
resúmenes y producciones de textos interpretativos. Dificultada para cumplir con las labores académicas programadas. |
|||
|
Estrategia de mejoramiento |
Lectura detallada del texto y solución de las actividades
planteadas. Presentación del trabajo en la fecha estipulada. |
|||
|
Actividades y fechas de entrega |
Lectura
del texto La Alquimia. Desarrollo
del trabajo propuesto Fecha de
entrega: 26 de octubre
|
|||
FIRMA PADRE DE FAMILIA: ________________________________________________________________________
FIRMA DEL ESTUDIANTE: ________________________________________________________________________
La
Alquimia
¿Qué es la alquimia?
La alquimia es una antigua
disciplina filosófica y forma de pensamiento
especulativo, de tipo protocientífico. Fue practicada desde la Antigüedad
hasta el siglo XVIII, cuando fue desplazada por el surgimiento de la química.
Su práctica fue común en
territorios tan diversos como las antiguas Mesopotamia, Egipto, Persia, India,
China, Grecia y Roma, pero sobre todo en el Imperio Islámico (632-750 d. C.) y
en la Europa medieval. Abarcaba una vasta y compleja red de escuelas y
vertientes a lo largo de casi 4000 años de historia.
La alquimia se encontraba íntimamente
vinculada con la astrología, ya que el hombre antiguo buscaba una correlación
entre los asuntos de la tierra y los del cielo, y aspiraba a aprender a
manipularlos para su propio beneficio.
En ese sentido, entre los
intereses de la alquimia figuraban los de las disciplinas modernas de la
química, la metalurgia, la física, la medicina y la semiótica, pero también el
misticismo y el arte. Era a la vez una disciplina protocientífica y una
disciplina espiritual.
El nombre alquimia proviene del
árabe al-khimiya, de donde surgió también la palabra “química”. Este término
árabe probablemente provenga del vocablo griego khumeia (“verter juntos”,
“soldar” o “alear”) o del persa kimia (“oro”), ya que era un objetivo común de
la alquimia transformar elementos innobles en metales preciosos, como el oro.
Otra explicación sugiere como
origen del término la voz egipcia kême, que se empleaba como el nombre de
Egipto. De allí provenían los más antiguos textos alquímicos “sobre el arte de
fabricar oro y plata”, en palabras del emperador romano Diocleciano (244-311),
quien ordenó quemarlos en un decreto en el año 300.
La alquimia tuvo mala fama durante
gran parte de su historia. En algunos lugares solía ser arte de engañadores y
charlatanes, y en la Europa cristiana medieval era considerada fuente de
saberes ocultos, brujería y cabalismo.
Historia de la Alquimia
La historia de la alquimia es
larga y abarca tres continentes distintos: África, Asia y Europa. Se trata de
una historia compleja y de muchos puntos de intersección e influencia, pero
nada fácil de trazar, ya que los practicantes de estos saberes eran devotos del
lenguaje críptico y simbólico, haciendo particularmente herméticos sus textos.
A grandes rasgos, pueden
identificarse dos grandes tradiciones alquímicas: la oriental y la occidental.
La alquimia oriental tuvo su
origen en China e India. La primera estaba estrechamente vinculada con el
taoísmo, y posee en el cuerpo de textos de esta antigua religión su mayor
conjunto bibliográfico. Tiene importantes coincidencias con la medicina
tradicional china, la astrología china y el Feng Shui.
A diferencia de la variante
occidental, centrada en los materiales, la alquimia china fue una especie de
proto-farmacología. Es posible que la pólvora fuera uno de sus grandes
descubrimientos, y la búsqueda del elixir de la inmortalidad su gran cometido.
En cuanto a la variante india de
la alquimia, es una tradición mucho menos conocida, que se definía como “el
arte de obtener el zumo o néctar” (Rasa) de las cosas, la Rasayâna. Con ello se
buscaba sanar a los enfermos y rejuvenecer a los viejos.
Su objetivo era obtener el moksa:
la perfección, liberación o inmortalidad. Por ello, se emparenta frecuentemente
con la medicina ayurvédica y otras tradiciones metafísicas.
Por otra parte, la alquimia
occidental nació en Egipto, a inicios del período helénico (c. 300 a. C.), en
la ciudad griega de Alejandría, donde luego surgió la célebre biblioteca. Fue
fruto de la herencia hermética egipcia (cuya figura central fue el Hermes Trimegisto,
fusión del Thot egipcio y el Hermes griego).
La tradición hermética fue
reinterpretada a la luz de las visiones griegas pitagórica, jonista y gnóstica,
que proponían respectivamente la explicación del universo a partir de los
números, la concentración de los fenómenos naturales y la adoración de un
cosmos imperfecto.
A esta vertiente pertenece la
teoría de los cuatro elementos, que veía en toda la materia existente una
proporción variable de tierra, aire, agua y fuego. Esta tradición fue luego
transmitida al Imperio Romano, en donde fue practicada hasta el surgimiento del
cristianismo, que vio en gran parte de ella un conjunto de saberes paganos y
heréticos.
Buena parte de los saberes
alquímicos se practicaban en la Europa medieval, durante el oscurantismo. Sin
embargo, tras la caída del Imperio Romano, fue el mundo islámico en donde
florecieron estas artes, libres de la persecución religiosa cristiana.
De hecho, en el Imperio Islámico
fue donde realmente floreció la alquimia medieval, añadiendo grandes aportes a
la tradición que se sostenía en los textos traducidos del griego de Platón y
Aristóteles: un contraste importante con occidente, donde muchos textos
alquímicos se perdieron para siempre.
Posteriormente, la alquimia
islámica fue la encargada de reintroducir sus saberes a Occidente, en donde
sentó las bases para el posterior nacimiento de la química.
La piedra filosofal
Uno de los lugares comunes más
célebres de la tradición alquímica es el de la Piedra filosofal. Se trataba de
una sustancia legendaria cuyas propiedades únicas permitían transmutar los
metales, esto es, convertir el plomo en oro o en plata.
Según otras tradiciones, también
conducía a la inmortalidad o al elixir del rejuvenecimiento. Fue el tesoro más
ambicionado de los alquimistas durante siglos, y a los intentos por dar con
ella se les conocía como Opus magnum (“Grandes obras”).
En el lenguaje místico y hermético
de la alquimia, en el que abundan símbolos, la piedra filosofal ocupa un lugar
central como emblema de la perfección, la iluminación y la felicidad celestial.
Según esta tradición, la piedra fue entregada por Dios al mismísimo Adán, y fue
responsable de la longevidad de los patriarcas bíblicos.
Alquimistas famosos
Algunos de los más célebres
alquimistas de la historia fueron:
Zósimo de Panópolis (s. III – IV
a. C.). Alquimista griego nacido en el Alto Egipto, autor de los textos
alquímicos más antiguos que se conocen, perdidos irremediablemente en algún
momento de la historia. Se sabe de su existencia gracias a traducciones al
sirio o al árabe, o por citas en otros textos en su griego original.
Ge Hong (283 – c.364). Escolar
chino de la temprana dinastía Jin, fue un alquimista y creador de los primeros
auxilios en la medicina tradicional china. También fue un pensador taoísta y
cultor de las artes marciales, llegando a ser una figura central en la cultura
china de la época.
Yabir ibn Hayyan (721-815). Conocido
en Occidente como Geber, fue un polímata y alquimista musulmán, considerado el
remoto fundador de la química. Su identidad y la extensión de su obra son
motivo de debate desde el siglo X hasta hoy en día. Se le atribuye erróneamente
el descubrimiento de distintas sustancias químicas, ya que un alquimista
posterior asumió su nombre como homenaje, siendo conocido hoy como el
Pseudo-Gerber italiano o español.
Al-Razi (c. 865 – c. 925). Médico, filósofo
y alquimista de origen persa, conocido como Rhazes o Rasis en Occidente. Fue
autor de más de 184 textos sobre medicina, química y física, y se le atribuye
el descubrimiento del ácido sulfúrico y del etanol, componentes clave en la
química moderna.
Al-Biruni (973-1048). Pensador
persa, dedicado a la alquimia y a las matemáticas, física, filosofía,
farmacéutica, y también la historia. Fue uno de los mayores pensadores del
mundo islámico, autor de más de 150 textos sobre temas variados, de los cuales
sobrevive apenas una quinta parte, por desgracia.
Nicolás Flamel (c. 1330 – 1418).
Considerado tradicionalmente como el alquimista francés por excelencia, fue un
burgués muy adinerado y célebre de quien se dijo que había obtenido sus
riquezas mediante la práctica de la “filosofía hermética”, o sea, la alquimia.
Sin embargo, esta creencia fue mucho después desmentida, a pesar de que en
siglos posteriores se le atribuyeron diversas obras protocientíficas. Flamel
realmente se dedicó a la escribanía pública y a ser copista.
Paracelso (1493 – 1541).
Alquimista, médico y astrólogo suizo, conocido también como Teofrasto Paracelso
o como Theophrastus Bombast von Hohenheim. Se le atribuyó en su momento haber
transmutado el plomo en oro, pero sus mayores aportes en realidad están en el
área de la farmacología y toxicología, disciplina esta última de la cual se le
considera padre fundador. También le dio su nombre al zinc (zincum).
Alquimia y química
Es llamativo que al-kîmiya en
árabe moderno se traduce “la química”, evidenciando el estrecho nexo entre esta
disciplina científica y la tradición alquímica. Esta última buscaba comprender
la dinámica de los materiales para transformar (“transmutar”) unos en otros y
obtener no sólo tesoros, sino también remedios y pócimas.
De hecho, en el siglo XVII la
alquimia era considerada una ciencia más o menos seria. Pensadores de la talla
de Isaac Newton dedicaron enormes porciones de su tiempo a su estudio, así como
otros de los primeros científicos occidentales.
Podría decirse que la química
nació de los apéndices de la alquimia tradicional, gracias a su reinterpretación
a manos del racionalismo. Así, se lograron resultados mucho más exitosos
mediante la aplicación del método científico, que insistiendo en la antigua
tradición hermética.
Con el nacimiento de la química,
la alquimia fue relegada a un rincón de la historia de la ciencia, o de la
historia del pensamiento. Sin embargo, pasó todavía más de un siglo antes de
que la separación formal de ambos nombres tuviera lugar, pues hasta entonces
fueron prácticamente sinónimos.
Trabajo
a desarrollar
1. 1.De acuerdo
a las imágenes, que ilustran la alquimia, puedo deducir
que:__________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
2. 2.Tomando en
cuenta la expresión: “forma de pensamiento especulativo, de tipo
protocientífico”, se podría decir que la alquimia fue:
__________________________________________________________________________________
__________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
3. 3.La piedra filosofal
para los alquimistas consistía en: _______________________________________________________________________________
___________________________________________________________________________________
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
4. 4.¿En la
actualidad podríamos hablar de la piedra filosofal? Sustenta la respuesta:
___________________________________________________________________________________
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
___________________________________________________________________________________
5. 5.Tomando en
cuenta el contenido del texto de la alquimia, completar el siguiente cuadro:
|
Espacio geográfico |
Personajes |
Prácticas |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6. 6.Realizar
mapa conceptual con los principales alquimistas y sus aportes:
1. 7.Por qué se
dice que la química surge a partir de la alquimia:
_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
2. 8.En la
antigüedad muchos alquimistas, fueron calificados como brujos, herejes:
_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
3. 9. ¿Qué importancia tuvo la práctica de la alquimia?
Aprendizajes
a Desarrollar
-Encuentro diferencias entre cambio químico y físico.
-Identifico los componentes de las ecuaciones
químicas.
-Identifico reacciones químicas en situaciones
cotidianas.
-Reconozco los aspectos fundamentales de la teoría de
las colisiones moleculares.
-Asumo una actitud de responsabilidad en la
presentación de los trabajos a tiempo y de buena calidad.
Reacciones químicas
https://www.youtube.com/watch?v=ZHG-gffv2e8
1. Observa el video y extrae 5 ideas fundamentales.
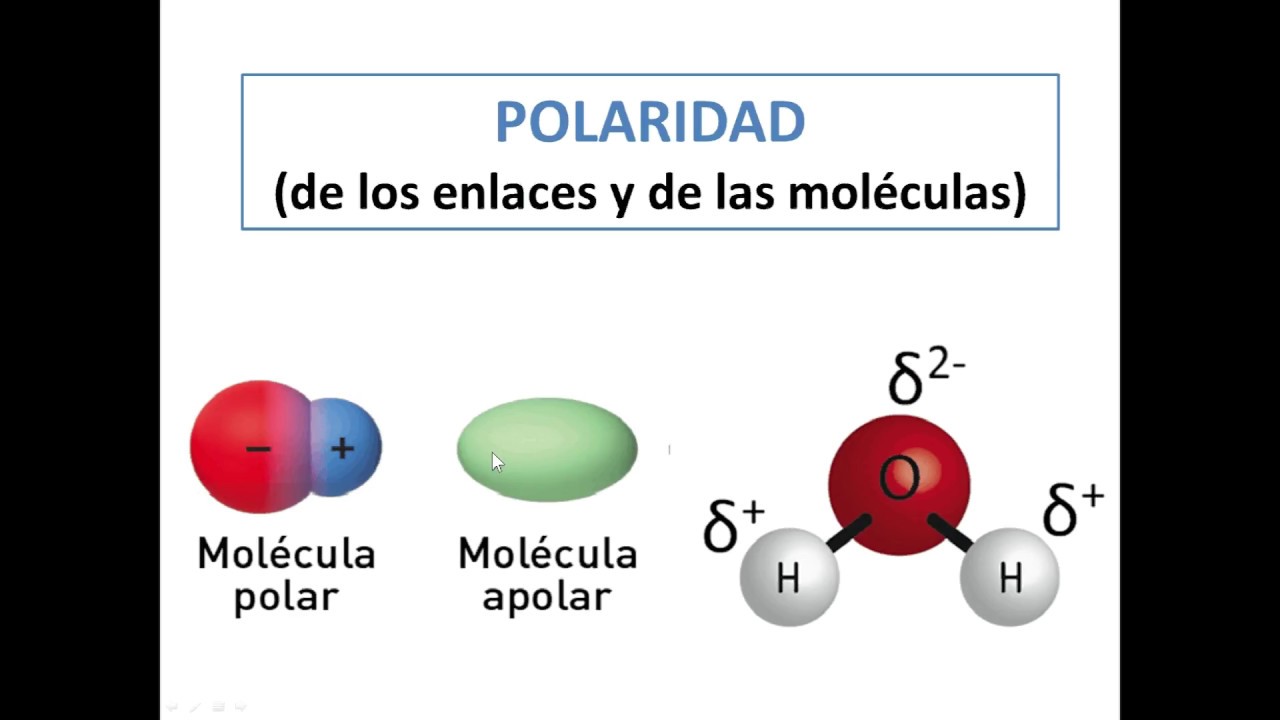
En la figura se representa el movimiento de las partículas de un gas, al abrir un recipiente y como estas se esparcen y se combinan con las partículas del aire, también se ilustra la distribución de las moléculas que conforman el dado (un sólido) y como estas no se combinan con el aire.
2. Responde a la pregunta partiendo de la
observación de los gráficos:
Donde
es más posible que se dé una reacción. Cuando los reactivos están en estado
sólido o en estado gaseoso?
__________________________________________________________________________
__________________________________________________________________________
¿Es
posible que al unirse el gas, que se encuentra en el recipiente, con algún
elemento que conforme la mezcla de gases del aire, forme un nuevo compuesto?.
Sustente la respuesta.
__________________________________________________________________________
__________________________________________________________________________
_______________________________________________________________________
Reacciones químicas y colisiones entre moléculas
https://www.youtube.com/watch?v=zzfvr4efUto
3. Realiza un resumen del video.
4. Observa el gráfico y explica si hubo
una reacción química. ¿Qué elementos reaccionaron?. ¿qué producto se obtuvo?
__________________________________________________________________________
__________________________________________________________________________
Cuando algunas sustancias se ponen en contacto
bajo determinadas condiciones, interactúan dando lugar a nuevas
sustancias, se genera un proceso de cambio.
Las sustancias que
se transforman se llaman reactivos, y las sustancias
resultantes de la transformación se denominan productos.
|
Reactivos |
Productos |
|
CH4 + 2O2
|
2H2 O + CO2 |
|
Átomos de C:1 Átomos de H:4 Átomos de O:4 |
Átomos de C:1 Átomos de H:4 Átomos de O:4 |
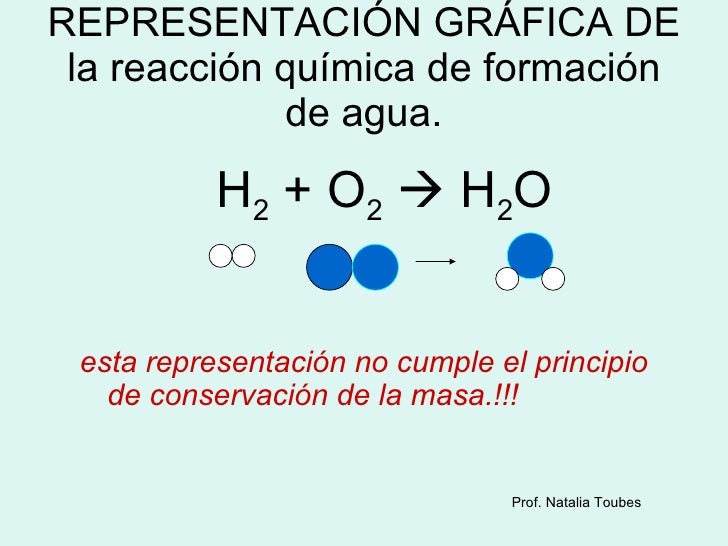
Una molécula de metano CH4 reacciona con dos moléculas de oxígeno O2, para producir dos moléculas agua 2H2O y una molécula de dióxido de carbono CO2. Las reacciones químicas no solo se presentan en laboratorios, en la naturaleza la materia está sometida a cambios constantes. Ejemplo de ello son: la formación del agua, la respiración, el ciclo de agua, el ozono presente en la atmósfera.
5. Señala en la ecuación de la formación
del agua, los reactivos, los productos, la cantidad de cada elemento, como se
ilustró en el ejemplo del metano.
Transformaciones en la naturaleza
Estos cambios o transformaciones de
la materia pueden ser físicos o químicos, y dependen si se modifica o no la estructura
interna de las sustancias.
|
Cambio físico (figura
6 y 7) |
Cambio químico (figura
8 y 9) |
|
No existe modificación en la naturaleza de las sustancias que
intervienen en la reacción: Ejemplo: • Separación de sustancias, sea en mezclas o disoluciones • Cambios de estado de la materia • Disoluciones Mezclas
|
Se altera la naturaleza de las sustancias, haciendo que cambien las
propiedades de los reactivos con respecto al producto. Ejemplo: • Oxidación del hierro • La digestión de los alimentos • La fotosíntesis El proceso de fermentación |
6.
partiendo de la observación de las imágenes, escribe qué es un cambio físico y
químico.
_____________________________________________________________________________________
_____________________________________________________________________________________
_____________________________________________________________________________________
7. Dibuja el cubo de hielo y el fosforo encendido, escribe sobre la línea el tipo de cambio y explica la razón.
|
Cambio |
Cambio |
|
Figura 10. Cubos de hielo |
Figura 11. Fósforo |
|
|
|
En la imagen se relaciona la teoría de las colisiones moleculares con la velocidad de reacción.
8.Tomando
en cuenta el grafico, responder:
La velocidad con que ocurre una
reacción está determinada por:
La Teoría de las colisiones fue propuesta por Max Trautz y William Lewis en 1917, explicaba
cualitativamente las reacciones químicas, y por qué las tasas de reacción
varían en diferentes reacciones. En la figura 12 se observa una colisión eficaz
y otra ineficaz, esto se explica con la teoría de las colisiones que está
basada en la idea de que partículas reactivas deben colisionar para que una
reacción ocurra, pero solamente una cierta fracción del total de colisiones
tiene la energía para conectarse efectivamente y causar transformaciones de los
reactivos en productos (a). Cuando la molécula del reactivo no tiene ni la
energía suficiente, ni la orientación adecuada (ángulo) la colisión o choque
resultante es ineficaz (b).
La cantidad mínima de energía
necesaria para que esto suceda es conocida como, energía de activación.
Existen
dos tipos de colisiones:
• Horizontal –
Colisión más lenta
• Vertical – Colisió
n más rápida, colisión efectiva
Energía
de las reacciones químicas. Cualquier transformación química involucra cambios
energéticos, por el desprendimiento o absorción de energía.
Cuando
se forma un enlace la energía necesaria para romper el enlace es la misma
energía que se requiere para su formación. Existen dos formas de reacciones, la
exotérmica y la endotérmica.
Todas
las reacciones, independientemente de considerarse exotérmicas o endotérmicas,
requieren energía inicial para romper los enlaces entre los átomos de los
reactivos; a esta energía se le considera energía de activación. La energía
liberada o absorbida que generalmente se manifiesta en forma de calor, se
denomina calor de reacción, y se puede establecer un valor característico para
cada reacción. A la interpretación de los estos cambios energéticos se le
conoce como entalpía o contenido calórico.
La
entalpía se simboliza la con la letra H; comparando las reacciones con la
entalpia tenemos:
•Una
reacción exotérmica es aquella cuyo valor de entalpía es negativo, es decir, el
sistema desprende o libera calor al entorno (ΔH 0).
•Una
reacción endotérmica es aquella cuyo valor de entalpía es positivo, es decir,
el sistema absorbe calor del entorno (ΔH 0).
9.Al leer el texto, considero que estas
son las 5 ideas fundamentales:
______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
La velocidad de reacción química se define como la rapidez con la que los reactivos se transforman en productos. Los aspectos que determinan la velocidad de reacción son: Catalizador: hace referencia a una sustancia que en contacto físico con los reactivos, acelera, propicia e induce dicha reacción.
El aumento de la concentración de los reactivos hace más probable el choque entre dos moléculas de los reactivos, con lo que aumenta la probabilidad de que entre estos reactivos se de la reacción. En el caso de reacciones en estado gaseoso, la concentración de los reactivos se logra aumentando la presión, disminuyendo el espacio entre las moléculas.
10.Anota qué
aspectos determinan la velocidad de reacción.
1.
2.
3.
4.
5.____________________________________________________________________________
Ecuaciones químicas
11.
observo la imagen, identifico los reactivos y los productos, leo la ecuación y la escribo:
_________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Las reacciones se representan por medio de ecuaciones químicas, esta representación
se realiza por medio de fórmulas y símbolos de
lo que ocurre en una reacción
En la figura se ilustran los
componentes que identifican una ecuación química.
Al leer una ecuación
química se debe tener en cuenta que: los números ubicados antes de cada formula
molecular, representan la cantidad de materia expresada en moléculas o moles de
cada compuesto, como se expresa en la figura. Si la expresión es 1, no se
escribe.
La ecuaciones químicas deben proporcionar la mayor cantidad posible de
información, para ello se utilizan los siguientes símbolos.
2CO(g) + O2(g) = 2CO2(g)
___________________________________________________________________________________________
________________________________________________________________________________________
_________________________________________________________________________________________
2HgO(s) = 2Hg(l) + O2(g)
____________________________________________________________________________________________________________________________________________________________________________________
13.en las siguientes
ecuaciones, señalo todos los componentes, tomando como base el cuadro anterior.
Segunda entrega Cuarto Periodo
30 de octubre al 15 de noviembre
Aprendizajes
a Desarrollar:
-Asumo una actitud de responsabilidad en la
presentación de los trabajos a tiempo y de buena calidad.
-Reconoce en una reacción química, la Ley de la Conservación de la
Materia equilibrando ecuaciones sencillas.
- Identifica y clasifica los tipos de reacciones químicas que se dan en
la naturaleza.
- Completa correctamente las reacciones químicas propuestas y las
balancea por el método de tanteo o simple inspección.
Clasificación
de las reacciones químicas
https://www.youtube.com/watch?v=dtTi_xUeBlY
1. Realizar resumen del video y extraer 5 ideas fundamentales.
La clasificación de las reacciones químicas se determina a partir de las transformaciones que se
producen. A
continuación, se describen siete reacciones.
Reacciones de síntesis o combinación:
dos o más sustancias reaccionan para formar una nueva sustancia, presentando una estructura más
compleja que los
reactivos. La ecuación: A+B=AB
Pueden presentarse tres tipos de
reacciones de síntesis:
• Combinación de dos iones o elementos
para formar compuestos
• Combinación entre un ión o un
elemento y un compuesto para generar otro compuesto
• Reacción de dos compuestos para
formar un nuevo compuesto
Reacciones de desplazamiento: las sustancias involucradas desplazan un ion o
átomo de un elemento o compuesto de su posición inicial. Se pueden presentar
desplazamiento simple o doble.
Desplazamiento simple:
un átomo en estado reacciona con un compuesto, y desplaza un ion o átomo y
forman otro compuesto.
Desplazamiento doble:
dos compuestos reaccionan formando dos compuestos totalmente nuevos. Por lo
general las sustancias reaccionan que están en un medio acuoso. Se dividen las
reacciones de desplazamiento doble en:
Reacciones
de neutralización: ocurren entre
un ácido y una base, produciendo sal y agua. NaOH (ac) + HCl(ac) =NaCl(ac) +
H2O(l) Hidróxido de sodio + Ácido clorhídrico Cloruro de sodio + Agua
Reacciones
de precipitación: además del
intercambio de átomos o iones las sustancias reaccionantes dan lugar a un
precipitado o fase sólida insoluble. BaCl2 (ac) + Na2 SO4 (ac) = BaSO4 + 2NaCl
Cloruro de sodio + Sulfato de sodio Sulfato de Bario + Cloruro de sodio.
Reacciones
de descomposición: los compuestos
se descomponen para formar dos o más moléculas. La representación es: AB A+B
Pueden ser iones, elementos o compuestos. La descomposición del agua se lleva a
cabo a través del proceso de electrólisis, en la cual se requiere aplicar
electricidad. 2KCIO3 2KCL + 3O2 Existe otro tipo de reacción por descomposición
térmica, en la cual es necesario aplicar calor. CaCO3(s) CaO(s) + CO2(g)
Reacciones
exotérmicas: se presenta una liberación de energía en forma de
luz, calor o sonido. La combustión y la fermentación son ejemplos de reacciones
exotérmicas.
Reacciones
endotérmicas: es necesario un aporte constante de energía para
romper los enlaces de los reactivos. Un ejemplo de esta reacción es el proceso
de la fotosíntesis. CO2 +H2 O Glucosa + O2 5. Reacciones de óxido – reducción o
redox: Intercambio de electrones entre los reactivos para generar los
productos. Perdida de electrones Oxidación La ganancia de electrones Reducción
La respiración, reacción en una pila y la combustión de hidrocarburos son
ejemplos de reacciones redox.
Reacciones
reversibles e irreversibles: reacciones
reversibles, se presenta cuando los productos se forman el mismo tiempo que los
reactivos. Y se utiliza una flecha en un solo sentido. 7. Reacciones
irreversibles, se producen cuando los reactantes se consumen totalmente hasta
convertirse en los productos. Ejemplo la combustión.
1. 2.Tomando en cuenta las siguientes pistas: construye
el crucigrama
Horizontales
6- Hace referencia al proceso de
aplicar electricidad a una reacción
8- Reacción de liberación de
energía en forma de luz, calor o sonido
9- La ecuación A+B → AB
corresponde a una reacción
Verticales
1- Interpreta los cambios energéticos
de las reacciones químicas y se simboliza con la letra H
2- Sustancia que disminuye la
energía de activación de una reacción
3- La fermentación y la combustión
son ejemplos de reacciones
4- Intercambio de electrones entre
los reactivos para formar los productos
5- Reacciones que ocurren entre un
ácido y una base, para producir sal y agua
6- La fotosíntesis es un ejemplo
de las reacciones
7- Reacción en la que se debe aportar energía constante para romper enlaces de los reactivos.
3.Tomando en cuenta los métodos utilizados, para explicar los tipos de reacciones químicas, proponga un método creativo para ilustrar 5 de ellas.
4. Realiza un mapa conceptual con todas las clases de reacciones químicas.
BALANCEO DE ECUACIONES
https://www.youtube.com/watch?v=HBhVcpXu0Ck
5. Realizar resumen del video.
Balancear una ecuación
química es igualar el número y clase de átomos, iones o moléculas
reactantes con los productos, con la finalidad de cumplir la ley de
conservación de la masa. Existen
distintos métodos los cuales se adecúan al tipo de reacción
que se esté estudiando: Método de
tanteo Método algebraico Método redox (o de medias
reacciones) Método del ion-electrón.
Una ecuación química balanceada nos proporciona la siguiente información: Compuestos que reaccionan, es decir, reactivos y productos. Cantidad de reactivo y cantidad de productos. Balance de masa y descomposición de compuestos.
Reglas para el balanceo por
tanteo
-Toda ecuación química consta de reaccionantes
y productos.
-Para balancear una ecuación química se colocan
delante de las fórmulas, unos números llamados coeficientes, de tal manera que
el número de átomos en ambos miembros de la ecuación sea exactamente igual.
-El coeficiente 1 no se coloca, ya que se
sobreentiende.
- Los coeficientes afectan a toda la sustancia
que preceden.
- Los coeficientes multiplican a los
sub-índices que presentan las fórmulas.
- En caso de que un compuesto tenga paréntesis,
el coeficiente multiplicará al sub-índice y luego este multiplicará a los
sub-índices que están dentro del paréntesis.
El hidrógeno y el
oxígeno se balancean al final (aunque hay excepciones) porque generalmente
forman agua (sustancia de relleno).
En algunos casos es
recomendable empezar a balancear los metales, luego los no metales (que no sean
oxígeno e hidrógeno), seguido del oxígeno y finalmente el hidrógeno.
Ejercicios
Resueltos
1.- Ca + HCl → CaCl2 + H2
Esta es muy sencilla, como podemos observar
el hidrógeno y el cloro están desbalanceados.
Del lado de los reactantes hay:
Ca = 1
H = 1
Cl= 1
Del lado de los productos hay:
Ca = 1
H = 2
Cl= 2
Entonces se debe colocar un coeficiente que al multiplicarlo por 1 de
como resultado 2, del lado donde está la deficiencia de átomos, que en este
caso seria el de los reactantes. Por tal razón, se coloca un 2 adelante del
HCl, quedando:
Ca + 2HCl → CaCl2 + H2
2.- Al + O2 → Al2O3
del lado de los reactantes
tenemos:
Al= 1
O= 2
Del lado de los productos tenemos:
Al= 2
O=3
En este caso todas las sustancias están desbalanceadas. Como se puede
observar, el oxígeno está desbalanceado y de un lado tenemos un número par y
del otro un número impar. Cuando sucede así, recomiendo empezar por el oxígeno
y multiplicar en el lado impar, por un número par para así obtener otro número
par:
Al + O2 → 2Al2O3
Ahora queda del lado de los
productos:
Al = 4
O= 6
Finalmente, balanceo del lado de los
reactantes colocando coeficientes tanto en el oxígeno como en el aluminio:
4Al
+ 3O2 → 2Al2O3
6. Balancear por tanteo las siguientes ecuaciones
a.Fe + H2SO4 → Fe2 (SO4)3 + H2
b.P2O5 + H2O → H3PO4
c. Mn2O7 → MnO2 + O2
d. Sb + HCl → SbCl3 + H2
e. PbS + O2 → PbO + SO2
f. CaCO3 → CaO + CO2
g. Fe(OH)3 + H2SO4 → Fe2 (SO4)3 + H2O
Nota: es importante, observar los videos, para facilitar la solución de las preguntas planteadas.
Tercera entrega cuarto periodo
Del 15 al 23 de noviembre
Aprendizajes
a Desarrollar:
-Asumo una actitud de responsabilidad en la
presentación de los trabajos a tiempo y de buena calidad.
-Reconozco la importancia de las reacciones químicas en los procesos
biológicos del organismo humano.
- Explica la importancia de las reacciones químicas en los procesos
metabólicos.
Reacciones
químicas en los procesos metabólicos
1.
Realiza un escrito sobre lo que
interpreta de la imagen y su relación con los procesos metabólicos.
Metabolismo
Cada vez que
das un mordisco a un bocadillo o un sorbo a un batido de frutas, tu cuerpo
tiene que trabajar duro para procesar los nutrientes que has ingerido. Mucho
después de que dejes el plato limpio como una patena y digieras los alimentos,
los nutrientes que habrás ingerido se convertirán en los componentes básicos y
combustible que necesita tu cuerpo para funcionar y crecer. Tu cuerpo obtiene
la energía que necesita de los alimentos a través de un proceso denominado
metabolismo.
¿En qué
consiste el metabolismo?
El metabolismo es
un conjunto de reacciones químicas que tienen lugar en las células del cuerpo.
El metabolismo transforma la energía que contienen los alimentos que ingerimos
en el combustible que necesitamos para todo lo que hacemos, desde movernos
hasta pensar o crecer. Proteínas específicas del cuerpo controlan las
reacciones químicas del metabolismo, y todas esas reacciones químicas están
coordinadas con otras funciones corporales. De hecho, en nuestros cuerpos
tienen lugar miles de reacciones metabólicas simultáneamente, todas ellas reguladas
por el organismo, que hacen posible que nuestras células estén sanas y
funcionen correctamente.
El metabolismo
es un proceso constante que empieza en el momento de la concepción y termina
cuando morimos. Es un proceso vital para todas las formas de vida -no solo para
los seres humanos. Si se detiene el metabolismo en un ser vivo, a este le
sobreviene la muerte.
He aquí un
ejemplo de cómo funciona el proceso del metabolismo en los seres humanos -y
empieza con las plantas. En primer lugar, las plantas verdes obtienen energía a
partir de la luz solar. Las plantas utilizan esa energía y una molécula
denominada clorofila (que les proporciona su color verde característico) para
fabricar azúcares mediante el agua y el dióxido de carbono. Este proceso se
denomina fotosíntesis y probablemente ya lo has estudiado en clase de
biología.
Cuando las
personas y los animales ingieren plantas (o, si son carnívoros, ingieren carne
de animales que se alimentan de plantas), incorporan esa energía (en forma de
azúcar), junto con otras sustancias químicas fundamentales para fabricar
células. El siguiente paso consiste en descomponer el azúcar a fin de que la
energía producida pueda ser distribuida a todas las células del cuerpo, las
cuales la utilizarán como combustible.
Después de
ingerir un alimento, unas moléculas presentes en el sistema digestivo
denominadas enzimas descomponen las proteínas en aminoácidos, las
grasas en ácidos grasos y los hidratos de carbono en azúcares simples (como la
glucosa). Aparte del azúcar, el cuerpo puede utilizar tanto los aminoácidos
como los ácidos grasos como fuentes de energía cuando los necesita. Estos
compuestos son absorbidos por la sangre, que es la encargada de transportarlos
a las células. Una vez en el interior de las células, intervienen otras enzimas
para acelerar o regular las reacciones químicas necesarias pata “metabolizar”
esos compuestos. Durante este proceso, la energía procedente de los compuestos
se puede liberar para que la utilice el cuerpo o bien almacenar en los tejidos
corporales, sobre todo en el hígado, los músculos y la grasa corporal.
De este modo,
el metabolismo es una especie de malabarismo en el que intervienen
simultáneamente dos tipos de actividades: la fabricación de tejidos corporales
y la creación de reservas de energía, por un lado, y la descomposición de
tejidos corporales y de reservas de energía para generar el combustible
necesario para las funciones corporales, por el otro:
El anabolismo,
o metabolismo constructivo: consiste en fabricar y almacenar: es la base del
crecimiento de nuevas células, el mantenimiento de los tejidos corporales y la
creación de reservas de energía para uso futuro. Durante el anabolismo,
moléculas simples y de tamaño reducido se modifican para construir moléculas de
hidratos de carbono, proteínas y grasas más complejas y de mayor tamaño.
El catabolismo,
o metabolismo destructivo: es el proceso mediante el cual se produce la energía
necesaria para todas las actividades. En este proceso, las células descomponen
moléculas de gran tamaño (mayoritariamente de hidratos de carbono y grasas)
para obtener energía. La energía producida, aparte de ser el combustible
necesario para los procesos anabólicos, permite calentar el cuerpo, moverlo y
contraer los músculos. Cuando descomponen compuestos químicos en sustancias más
simples, los productos de desecho liberados en el proceso son eliminados al
exterior a través de la piel, los riñones, los pulmones y los intestinos.
Varias hormonas
fabricadas por el sistema
endocrino se encargan de controlar la velocidad y el
sentido (“ana” o “cata”) del metabolismo. La tiroxina, una hormona
producida y segregada por la glándula tiroidea, desempeña un papel
fundamental en la determinación de la velocidad a la que se producen las
reacciones químicas del metabolismo en el cuerpo de una persona.
Otra glándula,
el páncreas, secreta o segrega hormonas que ayudan a determinar si la
principal actividad metabólica del cuerpo en un momento dado será anabólica o
catabólica. Por ejemplo, después de una comida principal generalmente predomina
el anabolismo sobre el catabolismo porque el hecho de comer aumenta la
concentración de glucosa -el principal combustible del cuerpo- en sangre. El
páncreas capta la mayor concentración de glucosa y libera la
hormona insulina, que indica a las células que aumenten sus actividades
anabólicas.
El metabolismo
es un proceso químico complejo, por lo que no es de extrañar que mucha gente
tienda a simplificarlo, concibiéndolo meramente como algo que determina la
facilidad con que nuestro cuerpo gana o pierde peso. Es aquí donde entran en
juego las calorías. Una caloría es una unidad que mide cuánta energía
proporciona al cuerpo un alimento en concreto. Una barrita de chocolate tiene
más calorías que una manzana, lo que significa que aporta al cuerpo más energía
-y a veces más de la que este necesita. Del mismo modo que un coche almacena la
gasolina en el depósito hasta que la necesita para alimentar al motor, el
cuerpo almacena calorías -principalmente en forma de grasa. Si llenas
excesivamente el depósito de gasolina de un coche, esta desbordará el depósito
y se derramará sobre la calzada. Del mismo modo, si una persona ingiere
demasiadas calorías, estas “se desbordarán” en forma de exceso de grasa
corporal.
La cantidad de
calorías que quema una persona en un día está influida por la cantidad de
ejercicio físico que hace, la cantidad de grasa y músculo que contiene su
cuerpo y su metabolismo basal. El metabolismo basal es una medida de
la velocidad a la que una persona “quema” energía, en forma de calorías, en
estado de reposo, es decir, mientras descansa. El metabolismo basal puede
desempeñar un papel en la tendencia de una persona a ganar peso. Por ejemplo,
una persona con un metabolismo basal lento (es decir, que quema pocas caloría
mientras duerme) tenderá a ganar más peso que una persona de la misma talla con
un metabolismo basal promedio que coma la misma cantidad de alimento y haga la
misma cantidad de ejercicio.
¿Qué factores
influyen en el metabolismo basal de una persona?
Hasta cierto punto, el metabolismo basal se
hereda -se transmite de padres a hijos a través de los genes. Pero a veces los
problemas de salud pueden repercutir sobre el metabolismo basal. Pero, de
hecho, una persona puede modificar hasta cierto punto su metabolismo basal de
varias formas diferentes. Por ejemplo, si una persona empieza a hacer más
ejercicio, no solo quemará más calorías directamente a través de la actividad
física sino que el hecho de estar más en forma también acelerará su metabolismo
basal. El metabolismo basal también está influido por la composición corporal
-las personas que tienen más músculo y menos grasa suelen tener un metabolismo
basal más rápido.
Problemas que
pueden afectar al metabolismo
La mayor parte
del tiempo el metabolismo funciona eficazmente sin que ni siquiera tengamos que
pensar en ello. Pero a veces el metabolismo de una persona puede provocar
bastantes estragos en forma de trastorno metabólico. En sentido amplio, un
trastorno metabólico es cualquier afección provocada por una reacción química
anómala en las células del cuerpo. La mayoría de trastornos metabólicos
obedecen bien a la existencia de concentraciones anómalas de enzimas u hormonas
en sangre o bien a problemas en el funcionamiento de esas enzimas u hormonas.
Cuando determinadas sustancias químicas no se pueden metabolizar o se
metabolizan de forma defectuosa, esto puede provocar una acumulación de sustancias
tóxicas en el cuerpo o una deficiencia de sustancias necesarias para el
funcionamiento normal del cuerpo; ambas situaciones pueden provocar síntomas
graves.
Entre las
enfermedades y trastornos metabólicos más frecuentes se incluyen los siguientes:
Hipertiroidismo. El
hipertiroidismo se debe a una glándula tiroidea excesivamente activa. Esta
glándula segrega una cantidad excesiva de tiroxina, lo que acelera el
metabolismo basal. Provoca síntomas como pérdida de peso, aceleración de la
frecuencia cardiaca, hipertensión arterial, ojos saltones e hinchazon en el
cuello provocada por el agrandamiento de la glándula tiroidea (bocio). Esta
enfermedad se puede controlar mediante medicación, cirugía o radioterapia.
Hipotiroidismo. El
hipotiroidismo se debe a una glándula tiroidea inexistente o poco reactiva y
suele ser consecuencia de un problema evolutivo o de una enfermedad que
destruye la glándula tiroidea. Esta glándula segrega una cantidad insuficiente
de tiroxina, lo que ralentiza el metabolismo basal. Cuando el hipotiroidismo no
se trata puede provocar problemas cerebrales y de crecimiento. El
hipotiroidismo ralentiza los procesos corporales y provoca fatiga, descenso de
la frecuencia cardíaca, ganancia de peso excesiva y estreñimiento. Los jóvenes a
quienes les diagnostican este trastorno se pueden tratar con hormona tiroidea
administrada por vía oral (por boca) a fin de que tengan una concentración
normal de esta hormona en el cuerpo.
Errores
congénitos del metabolismo. Algunas enfermedades metabólicas se heredan.
Estas enfermedades se conocen como errores congénitos del metabolismo. Al poco
tiempo de nacer un bebé, se evalúa si padece muchas de esas enfermedades
metabólicas. Los errores congénitos del metabolismo a veces pueden provocar
problemas graves si no se controlan a través de la dieta o con medicación desde
muy pronto. Ejemplos de este tipo de trastornos incluyen
la galactosemia (los bebés que nacen con este problema no tiene
suficiente cantidad de una enzima encargada de descomponer el azúcar de la
leche, denominado galactosa) y la fenilcetonuria (este trastorno está
provocado por un defecto en la enzima encargada de descomponer el aminoácido
fenilalanina, necesario para el crecimiento normal y la fabricación de
proteínas). Los jóvenes pueden necesitar seguir una dieta especial y/o tomar
medicamentos para controlar problemas metabólicos de nacimiento.
Diabetes tipo
1. La
diabetes tipo 1 ocurre cuando el páncreas no produce o secreta suficiente
insulina. Los síntomas de esta enfermedad incluyen orinar en exceso, tener
mucha sed y mucha hambre y perder peso. A la larga, esta enfermedad puede
provocar problemas renales, dolor provocado por lesiones neuronales, ceguera y
enfermedad cardiovascular. Los jóvenes que padecen diabetes tipo 1 necesitan inyectarse
insulina regularmente y controlarse la concentración de azúcar en sangre a fin
de reducir el riesgo de desarrollar problemas de salud a consecuencia de la
diabetes.
Diabetes tipo
2. La
diabetes tipo 2 ocurre cuando el cuerpo no responde a la insulina con
normalidad. Los síntomas de este trastorno son parecidos a los de la diabetes
tipo 1. Muchos jóvenes y niños que desarrollan este tipo de diabetes tienen
sobrepeso, que se cree que desempeña un papel importante en su menor
reactividad a la insulina. Algunas personas pueden tratarse eficazmente con
cambios dietéticos, ejercicio y medicación por vía oral, pero en otros casos
son necesarias las inyecciones de insulina. Controlar la concentración de
azúcar en sangre reduce el riesgo de desarrollar los mismos problemas de salud
a largo plazo asociados a una diabetes tipo 1 no tratada o mal controlada.
2. ¿Cuáles de tus actividades diarias consideras que son indispensables para poder vivir?
3. ¿Cuáles son las principales fuentes de energía que utilizamos para realizar nuestras actividades diarias?
1. 4. ¿Cómo crees que se transforman en energía?
1. 5. ¿Cómo crees que
se transforman en energía los alimentos que consumimos para poder realizar
nuestras actividades?
Se 6. Se conoce con el nombre de metabolismo a:
7.¿Cuáles son las fases del metabolismo-Catabolismo?
8. ¿Cuáles son las funciones y características del metabolismo?
Es 9. ¿Por qué es importante el conocimiento de este tema, para mi vida práctica?
10. Completa el cuadro, tomando en cuenta las
enfermedades metabólicas:
}
|
Enfermedad o trastorno metabólico |
Causas |
Características |
Tratamiento preventivo |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
11. ¿ Que es el metabolismo basal y como se puede modificar?
Q 12. ¿Qué consecuencias puede generar el trastorno del metabolismo?
https://www.youtube.com/watch?v=IHJSpPpdNY0
13. Realizar resumen del video






























Hola profe buenas tardes, profe era para solicitar un video conferencia para salir de dudas de unos temas de el taller.
ResponderEliminarFelipe Rengifo 10B
https://www.youtube.com/watch?v=ivhWTvrgPzc
ResponderEliminar7u7
EliminarJsjsjs ùwú
Eliminaro-o
Eliminar;-;
Eliminar.________.
Eliminar°<B3
Eliminaresto se puede hacer en word? lo hize en word, espero no hayan inconvenientes, gracias
ResponderEliminarprofe en la guia dice que es para el 15/11/2020 pero el 15 cae un domingo?
ResponderEliminar