Se les recomienda almacenar los trabajos en una carpeta, para que los envíen en el momento que se les solicite (fotos del cuaderno, archivos con trabajos. etc)
En la semana del 20 al 24 de abril y del 27 de abril al 1 de mayo , deben realizar las actividades del primer periodo (1 a la 7), como observaran son muy cortas.
Conceptos para recordar
¿Qué es genética?
Rama de las ciencia biológicas que se dedica a el estudio de la naturaleza, organización, función, expresión, transmisión y evolución de la información genética codificada de los organismos; cuyo objetivo principal es explicar el modo en que los rasgos y las características se transmiten de padres a hijos.
Las tres áreas generales de la genética son: genética clásica, genética molecular, genética de poblaciones y evolución.
¿Qué es el ADN?
El ADN es la molécula que almacena la información genética de un organismo; es un ácido nucleico compuesto de nucleótidos. Los nucleótidos están a su vez compuestos de: una azúcar de 5 carbonos llamada desoxirribosa (de allí el nombre de ácido desoxirribonucleico ADN); un grupo fosfato (PO4 ), que le da una carga neta negativa y Una base nitrogenada (Adenina, Guanina, Citocina, Timina).
Diagrama de un nucleótido:
Actividad 1: tomando en cuenta la composición del ADN y modelo que se ilustra en la figura, propone un modelo diferente, que integre los conceptos estudiados. con el modelo de nucleótido construido, forma un fragmento de ADN, tomando en cuenta la complementariedad de las bases nitrogenadas.
Cómo se organiza el ADN en la célula?
La estructura del ADN es una doble cadena arreglada en una hélice doble; en la cadena, los nucleótidos están conectados unos con otros por medio de un enlace fosfodiestérico, que se forma cuando el grupo fosfato de un nucleótido se une a la molécula de azúcar del otro nucleótido, como se ilustra en la siguiente imagen:
¿Cómo se replica el ADN?
El ADN se replica de una manera semiconservativa, en la cual cada cadena parental es el templado de la nueva cadena. A manera general la replicación ocurre en tres pasos:
– iniciación
– la replicación comienza en el origen de replicación.
– elongación
– Las nuevas cadenas de ADN son sintetizadas por la Polimerasa de ADN.
– Terminación
A continuación se ilustra el proceso de replicación de forma gráfica y a través de dos cortos videos, para mayor claridad.
Actividad 2: tomando en cuenta el gráfico y los vídeos de la replicación del ADN, ilustra de manera gráfica y escrita cada una de las etapas de la replicación.
- Por qué es importante la replicación del ADN?. Qué función cumple?
- Completa la secuencia:
A C G A T G A T A C T C C G A T A G C G C A T A
⬇ ⬇ ⬇ ⬇ ⬇ ⬇ ⬇ ⬇ ⬇ ⬇ ⬇ ⬇ ⬇ ⬇ ⬇ ⬇ ⬇ ⬇ ⬇ ⬇ ⬇ ⬇ ⬇ ⬇
Actividad 3: da significado a cada concepto: proteína, traducción,aminoácido, ARN,polipéptido, transcripción.
- Por qué es importante la síntesis de proteínas?
Genética Mendeliana
Actividad 5: lee el párrafo anterior, analiza y argumenta, por que fue tan importante el trabajo de Gregorio Mendel. toma en cuenta su profesión y la época en que realizó su trabajo.
¿Pero en qué consistió el trabajo de Mendel?
Actividad 6: redacta en tu cuaderno en que consistieron los experimentos de Mendel: que plantas utilizó, por qué las seleccionó, que hizo con ellas y que observó.
- Da corto significado a las siguientes palabras: gen, alelo, hermafrodita, autopolinización, cruce, fenotipo, genotipo, polen.
- Con que características de las plantas de arvejas trabajó Mendel. Dibújalas
Experimento de Mendel
roja (dominante) y blanca (recesiva)
◘ Forma de la semilla:
Actividad 7: Observa con atención el gráfico donde se ilustra uno de los cruces que realizó Mendel en su experimento, termina de aclarar tus dudas viendo el video donde se explican las tres leyes de Mendel.
- Realiza resumen de cada una de las leyes.
- Aplica las leyes de Mendel, realizando ejercicios de cruces monohíbridos y dihíbridos, con los caracteres utilizados por Gregorio Mendel. no olvides enfrentar caracteres dominantes contra recesivos. (tres monohíbridos y dos dihíbridos).
NOTA: puedes realizar las actividades en el cuaderno o en medio magnético y enviarlas al siguiente correo rojashurtadoalbaines@gmail.com
Nombre
del estudiante
|
Grado
|
9
|
||
Período
|
Primero
|
Asignatura
|
Biología
|
|
Docente
|
Alba Inés Rojas Hurtado
|
|||
Competencias
|
|
|||
Aprendizajes
del periodo (el estudiante debe desarrollar los reportados en el boletín)
|
Identifico las etapas del método científico y las aplico en la solución de problemas de las ciencias naturales.
Reconozco la importancia del modelo de la doble hélice para la explicación del almacenamiento y transmisión del material hereditario. Establezco relaciones entre los genes, las proteínas y las funciones celulares. Comparo diferentes sistemas de reproducción Identifico los principios básicos de cruzamiento, las leyes de Mendel. Cumplo mi función cuando trabajo en grupo y respeto las funciones de las demás personas. Me informo para participar en debates sobre temas de interés general en ciencias. Explico la relación entre el ADN, el ambiente y la diversidad de los seres vivos. Realizo los talleres, trabajos y tareas, dentro y fuera del aula y las presento a tiempo. Valoro las ventajas y desventajas de la manipulación genética. Escucho activamente a mis compañeros y reconozco otros puntos de vista. |
|||
Descripción de la dificultad
para alcanzar el/los aprendizaje/s
|
Desinterés por el aprendizaje de los conceptos propuesto, irresponsabilidad en la realización de las tareas propuestas, falta de trabajo en equipo, deficiencia en las sustentaciones individuales.
|
|||
LITERAL
|
CONCEPTO
|
RELACIÓN
|
A
|
Centrosoma
|
B y C
|
B
|
Cromosomas
|
A y H
|
C
|
Genes
|
I y E
|
D
|
Código Genético
|
F y G
|
E
|
ADN
|
F y B
|
F
|
Núcleo
|
B y H
|
G
|
Nucléolo
|
I Y F
|
H
|
Huso Acromático
|
D y E
|
I
|
ARN
|
C y D
|
Reflexiono sobre los alcances y consecuencias negativas de la manipulación genética.
Argumento y debato sobre dilemas de la vida, en los que entra en conflicto el bien general y el bien particular.
A la luz de los conocimientos de la Biología Moderna, las Leyes de Mendel pueden ser reformuladas de la siguiente manera: Primera Ley: el par de Genes Alelos que participan en la determinación de un carácter, ocupan el mismo locus en los Cromosomas Homólogos.
Actividad 1
Lee con atención el texto y responde:
- De acuerdo al texto anterior, responder por qué ha sido tan importante para la humanidad, el descubrimiento del ADN y el desciframiento del código genético.
- Si observamos la imagen e indagamos en la historia, nos damos cuenta que el papel de la mujer en investigación científica, ha sido restringido. Dialoga con tu familia sobre éste hecho y escribe 5 posibles razones a ésta situación.
- En la actualidad, la mujer y otros grupos minoritarios tiene las mismas oportunidades que los hombres para incursionar en el campo de la ciencia y hacer investigación científica?. Redacta un texto donde expongas como son esas oportunidades.
- Cual es la diferencia entre genes dominantes y recesivos.
- que entiende por entre cruzamiento. consulte ejemplos, e ilustre con un ejemplo gráfico.
Herencia Ligada al Sexo: Morgan busco una mosca macho de ojos blanco (especie rara) para cruzarla con una mosca hembra de ojos rojo (especie común) dará en la F1 a todos los descendientes con ojos rojos; y al cruzarlos para la F2, se obtendrá las hembras con ojos rojos y los machos con un 50% de ojos blancos y un 50% de ojos rojos. También hizo lo mismo con moscas macho de ojos rojos (común) con hembras de ojos blancos (raro), dando que los machos tendrán ojos blancos y las hembras ojos rojos, para la F2 los machos y hembras poseerán un 50% de ojos rojos y el otro 50% de ojos blancos.
Actividad 2:
- Observa el gráfico y analiza el ejemplo que se ilustra de herencia intermedia. reproducelo en tu cuaderno y consultas dos ejemplos más.
- Lee el experimento de Morgan e ilústralo con dibujos.
- Toma en cuenta lo estudiado en genética; observa el fenotipo de tus progenitores y el tuyo, con detalle. Qué heredaste?. Hay relación con lo expuesto por Morgan?
Pueden
heredarla hombres y mujeres en la misma proporción, y para que se manifieste
tanto la madre como el padre deben transmitir la forma defectuosa del gen.
Daltonismo
- Realiza un mapa conceptual con los nombres y características de las enfermedades genéticas.
- Después de leer detenidamente sobre las
características de cada una de las enfermedades genéticas, reflexiona de manera
individual y en familia sobre la siguiente situación: Una pareja hace un
recorrido sobre su herencia y se da cuenta que tienen un alto porcentaje de
tener hijos con enfermedades genéticas y mal formaciones, que los harán
dependientes de otras personas durante toda su vida. Deben tener hijos?. No
deben tener hijos?. Que alternativas pueden tomar?. Sustenta cada una de las
respuestas.
- Crees que las enfermedades genéticas se pueden evitar?. Cuales?. Cómo?
- Observa la figura, interprétala y redacta un párrafo sobre lo que percibas en ella.
- Lee el párrafo y expresa si el desarrollo de la ingeniería genética ha traído beneficios a la humanidad. Si o No. Por qué?.
- Estás de acuerdo con la modificación de animales, personas?. Qué opinas de la clonación?.
- Entra al siguiente enlace, observa el video y realiza un resumen:https://www.youtube.com/watch?v=1RUEsTKoOGM&t=46s
El grupo sanguíneo A se caracteriza por:
El grupo sanguíneo B se caracteriza por:
El grupo sanguíneo AB se caracteriza por:
Se puede recibir sangre de cualquier tipo? Si-No. Por qué?
El donante universal tiene las siguientes características:
El receptor universal tiene las siguientes características:
Consideras que es importante donar sangre?. Por qué?
3.observa con mucha atención el video, estudia los conceptos relacionados y resuelve los ejercicios:
b. En una prueba de paternidad se ha comprobado que el grupo sanguineo de un niño es AB y el del supuesto padre es O. ¿Cuál crees que debe ser el veredicto?.
SEGUNDA PARTE DEL TRABAJO DEL SEGUNDO PERIODO
Las teorías sobre el origen de las especies
Creacionismo
El creacionismo clásico
|
Creacionismo pro-evolución
|
Diseño inteligente
|
3.Religiones como el judaísmo, el cristianismo, el islamismo entre muchas, sustentan que su dios es el creador del universo y todos los seres de la naturaleza, ¿entonces cual tiene la verdad? Y ¿por qué? .
Fijismo o fixismo
Un siglo después, el zoólogo y naturalista francés Georges Cuvier respondió a las voces en contra de la teoría fijista que aludían a la existencia de los fósiles con la teoría del catastrofismo. Según esta algunas especies desaparecieron como consecuencia de catástrofes y de ahí los fósiles.
Corriente que sostiene que el origen o evolución del Universo y los seres vivos son el
resultado de acciones racionales emprendidas de forma deliberada por uno o más agentes inteligentes (El Dios de las religiones monoteístas).
En realidad, es un movimiento creacionista que oculta sus motivaciones religiosas presentando experimentos y pruebas científicas modificadas y sacadas de contexto con el fin de lograr la respetabilidad ante la comunidad científica internacional.
Teoría de la generación espontánea
Fijismo
|
Diseño
inteligente
|
2. Que interpretas de la imagen que ilustra el diseño inteligente?. ¿En que se diferencia de las teorías creacionistas tradicionales?.
3.Se dice que la teoría de la generación espontánea fue reevaluada. con base en el video, sustenta esta afirmación.
4.Realiza un resumen del video. ¿que personajes se mencionan en el video y que aporte hizo cada uno a la ciencia. ilustrarlo en un cuadro:
Nombre del científico
|
Aporte a la ciencia
|
Lamarckismo
Es término utilizado para referirse a la teoría de la evolución formulada por Lamarck. En 1809 en su libro Filosofía zoológicapropuso que las formas de vida no habían sido creadas y permanecían inmutables, como se aceptaba en su tiempo, sino que habían evolucionado desde formas de vida más simples. Describió las condiciones que habrían propiciado la evolución de la vida y propuso el mecanismo por el que habría evolucionado. La teoría de Lamarck es la primera teoría de la evolución biológica. Propuso que la vida evolucionaba “por tanteos y sucesivamente”, “que a medida que los individuos de una de nuestras especies cambian de situación, de clima, de manera de ser o de hábito, reciben por ello las influencias que cambian poco a poco la consistencia y las proporciones de sus partes, de su forma, sus facultades y hasta su misma organización”. Sería la capacidad de los organismos de adaptarnos al medio ambiente y los sucesivos cambios que se han dado en esos ambientes, lo que habría propiciado la Evolución y la actual diversidad de especies.
Darwin, evolución y selección natural
- Charles Darwin era un naturalista británico que propuso la teoría de la evolución biológica por selección natural.
- Darwin definió la evolución como "descendencia con modificación", la idea de que las especies cambian a lo largo del tiempo, dan origen a nuevas especies y comparten un ancestro común.
- El mecanismo que Darwin propuso para la evolución es la selección natural. Debido a que los recursos son limitados en la naturaleza, los organismos con rasgos heredables que favorezcan la supervivencia y la reproducción tenderán a dejar una mayor descendencia que sus pares, lo que hace que la frecuencia de esas características aumente a lo largo de varias generaciones.
- La selección natural hace que las poblaciones se adapten o se vuelvan cada vez más adecuadas a su entorno con el paso del tiempo. La selección natural depende del medio ambiente y requiere que existan variaciones heredables en un grupo.
Jean
Baptiste Lamarck
|
Charles
Darwin
|
|
Nombre
de la Teoría
|
||
Principios
o argumentos
|
||
¿Esta
teoría fue aceptada por la comunidad científica?
¿Por
qué?
|
||
¿Cuál
teoría apoyaría y
¿por
qué?
|
b) De acuerdo con lo anterior, ¿considera correctas estas afirmaciones? ¿Por qué?
c)Observa el gráfico de las jirafas y escribe un párrafo sobre lo que interpretes de el.
e) Mi interpretación de la caricatura de Darwin es:
Teoría Sintética de evolución o nuevo Darwinismo
3.La teoría sintética es la verdadera? ¿puede ser reemplazada por otra? Sustente la respuesta.
|
Características de mis compañeros |
Características en común con ellos |
Características personales |
|
|
|
|
Las mutaciones
3.
Si el ADN es la molécula que
guarda las instrucciones de cómo somos y de cómo funciona cada una de nuestras
células y que dicha información es heredada en parte a nuestros hijos. Es
importante tener en cuenta que dicha información puede ser alterada por
mutaciones y que luego la información o instrucción no se va a entender y no se
logrará el buen funcionamiento de las células. Asimismo la frase “ Eres el
mejor amigo que tengo ahora” me permite recibir una información clara. ¡Qué tal
si le hiciéramos cambios-mutaciones a dicha información! ¿Cómo quedaría?
Deleción: el mejor amigo que tengo ahora (se perdió el fragmento eres).
Inversión: mejor el amigo que tengo ahora.
Duplicación: que el mejor amigo que tengo ahora.
Con
base en la información anterior, escriba una frase con una mutación o cambio,
descifre el mensaje original y el tipo de mutación presente.
4. Realice un mapa conceptual con las mutaciones y
su clasificación.
5. Exploración sobre conceptos de genéticas Tabla
|
¿Qué conozco sobre
la genética? |
¿Qué quiero saber
sobre la genética? |
¿Qué aprendí acerca
de la Genética Mendeliana? |
|
|
|
|
Las teorías sobre el origen de las especies
|
Teorías |
Exponentes |
Postulados |
|
Creacionistas
|
|
|
|
Generación espontánea
|
|
|
|
Evolucionistas
|
|
|
Las principales son: Síndrome de Down, Enfermedad de Huntington, Fibrosis quística, Distrofia Muscular de Duchenne, Anemia Falciforme, Síndrome X frágil.
7. tomando como base, la información desarrollada anteriormente, completar el cuadro:
|
Enfermedad |
Causas |
Características |
|
Síndrome de Down
|
|
|
|
Enfermedad de
Huntington.
|
|
|
|
Fibrosis quística
|
|
|
|
Distrofia Muscular de Duchenne
|
|
|
|
Anemia Falciforme
|
|
|
|
Síndrome X frágil
|
|
|
Aprendizajes a desarrollar
-Describe los estados de la materia en función de la
organización de partículas y de propiedades específicas.
-Compara las propiedades
físicas de materiales con diferente masa, volumen y densidad.
-Explica a partir de las fuerzas
intermoleculares, las propiedades físicas (solubilidad, la densidad, el punto
de ebullición y fusión y la tensión superficial) de sustancias liquidas.
-Explica qué factores afectan la
formación de soluciones a partir de resultados obtenidos en procedimientos de
preparación de soluciones de distinto tipo (insaturadas, saturadas y
sobresaturadas) en los que modifica variables (temperatura, presión, cantidad
de soluto y disolvente).
¿Qué
características tiene el agua del río Atrato?
El agua es una de las sustancias más
abundantes en la biosfera y ésta compone parte vital de nuestro cuerpo y el
mundo. Alguna vez se ha preguntado ¿por qué el agua moja? La pregunta pareciera
obvia pero no lo es. Por lo tanto, es necesario hablar de la estructura del
agua y sus propiedades.
La molécula de agua es triatómica, es
decir, está compuesta por tres átomos: dos de hidrógeno y uno de oxígeno,
unidos mediante enlaces.
que tienen diferente capacidad
(fuerza) para atraer los electrones. Estos átomos no están unidos en una línea
recta, pues la forma geométrica hace que la molécula tenga dos polos, como los
de un imán, con una carga negativa cercana al átomo de oxígeno y cargas
positivas cerca de los hidrógenos. Entre diferentes moléculas de agua se
generan fuerzas de atracción entre los átomos de hidrógeno (positivo) con los
átomos de oxígeno (negativo), de tal manera que las moléculas se mantienen
unidas y poseen una fuerza de adherencia que se manifiestan cuando las
moléculas entran en contacto con otra superficie. Por tal razón las fuerzas de cohesión1 que
son las fuerzas que mantienen unidas las partículas de agua (H2O) y las fuerzas
de adherencia2, aquellas que se manifiestan cuando las moléculas de agua entran
en contacto con otra superficie son las razones por las que el agua moja.
Cuando las fuerzas de cohesión son menores que las de adherencia, el líquido (agua) “moja” y lógicamente, cuando son mayores las de cohesión el líquido no mojará (como sucede, por ejemplo, con el mercurio)
Actividad 1
a. Ubica en cada óvalo, una característica
del agua.
|
Propiedades del Agua |
||
|
Físicas |
Químicas |
Biológicas |
|
|
|
|
Propiedades físicas del agua
Tensión superficial: Si alguna vez ha visto pequeños
insectos caminando sobre el agua, como si la superficie del agua actuara como
la piel, esta propiedad se debe a la fuerza de atracción mutua que se presenta
entre las moléculas del agua. Dichas fuerzas no son iguales en la superficie y
en el interior del líquido (agua). Las moléculas de agua que se encuentran en
el interior (abajo) están completamente rodeadas de otras moléculas de agua
(arriba, abajo y a los lados). En el interior del agua contenida en un
recipiente se anulan unas fuerzas con otras. Esto no ocurre en la en la
superficie y por ello esta película superior en el agua, formada por las
moléculas, presenta una fuerza en forma de red que hace que un insecto de muy
bajo peso con el peso repartido entre todas las patas, no se hunda. Lo
contrario ocurre en la molécula de la superficie ya que no tienen otras
moléculas arriba, del tal manera que la fuerza de atracción es muy fuerte hacia
las moléculas de los lados como con las que se encuentran abajo. A esa unión se
le denomina tensión superficial formando una especie de piel elástica sobre la
que se apoya el insecto; en comparación al insecto usted no puede caminar sobre
el agua ya que usted hace que esta tensión superficial disminuya y su cuerpo se
hunda.
Punto de ebullición: temperatura a la cual se produce el
cambio de estado líquido a gaseoso.
Punto de fusión: temperatura a la cual se produce el
cambio del estado sólido a líquido. A nivel del mar la temperatura de
ebullición del agua es de 100 °C y la de fusión es de 0 °C.
Densidad: es la cantidad de masa en un
determinado volumen. La densidad del agua es de 1 g/cm3, esto quiere decir que
en 1 cm3 de agua encontramos una masa de 1g. La densidad varía con la
temperatura y presión tal como se puede ver en la figura. El hielo es menos
denso porque si la misma masa aumenta de volumen esta relación disminuye; el
agua solida aumenta de volumen por la disposición de las moléculas.
Apariencia: es incolora, no tiene olor y no tiene
sabor, cualquier cambio en estas propiedades se debe a otras sustancias que
están disueltas en ella.
Propiedades disolventes del agua:
¿Alguna vez ha preparado limonada? Si
lo ha hecho, sabe que generalmente está acompañada de azúcar y agua. ¿Ha
observado cómo se mezclan los ingredientes en el momento de agregar el azúcar
en el agua? Seguramente sí. Por lo tanto, usted ha observado las propiedades
disolventes del agua. Un solvente es una sustancia que puede disolver otras
moléculas a las que se les conoce como solutos.
Debido a su estructura molecular y su
fuerza para atraer los electrones, el agua tiene una habilidad para establecer
enlaces estables con los átomos de hidrógeno de otras moléculas. El agua es un
excelente solvente, lo que significa que puede disolver muchos tipos de
moléculas diferentes por lo que es considerada como el “solvente universal”,
pero no todas las moléculas de todos los compuestos se disuelven en ella. Por
ejemplo, el aceite no se disuelve en agua. La naturaleza de las moléculas
influye en la disolución en agua; esta puede disolver moléculas polares
mientras que no puede disolver las apolares.
i. tomando en cuenta, la lectura
minuciosa de los textos anteriores, completar la siguiente tabla:
|
Ficha
Técnica Agua |
||
|
Nombre |
|
|
|
Fórmula Química |
|
|
|
Punto de fusión |
|
|
|
Punto de ebullición |
|
|
|
Densidad |
|
|
|
Propiedad como disolvente |
Solvente universal |
|
|
Formada por |
|
|
|
Conductividad |
|
|
|
Color |
|
|
|
Olor |
|
|
|
Sabor |
|
|
|
Utilidades |
|
|
El río Atrato es el tercer río más grande de Colombia y se considera uno de los más caudalosos del mundo. Este recorre gran parte del departamento de Chocó, pero desde hace mucho tiempo ha enfrentado efectos causados por la contaminación.
El agua puede contaminarse con diferentes
tipos de compuestos, así como con microorganismos y variaciones bruscas de
temperatura. De este modo se afecta toda la parte biótica y el oxígeno disuelto
en el agua y se afecta por lo tanto, la salud de los animales y los humanos.
1. 1.Contaminantes industriales: dentro de este grupo se encuentran
las sustancias tóxicas como hierro, magnesio, zinc, cobre y mercurio, los
cuales afectan las propiedades físicas del agua tales como: color, sabor y
textura.
2.
2.Contaminantes orgánicos: entre estas sustancias están los
detergentes responsables de la espuma y la concentración de impurezas; los
residuos sanitarios y las basuras generan malos olores, así como infecciones en
la población.
3.Contaminación biológica: la presencia de microorganismos como
bacterias y protozoos en el agua destinada a consumo humano constituye un grave
problema de salud pública, ya que estos organismos producen enfermedades graves.
4. Contaminación térmica: se produce cuando agua caliente,
proveniente de industrias, es vertida al agua. El agua caliente contiene menos
oxígeno disuelto que el agua más fría. Esto provoca alteraciones graves en la
estructura de las comunidades acuáticas (biodiversidad). Por ejemplo, el
calentamiento global ha ocasionado un gas que atrapa el calor y aumenta la
temperatura del planeta en el mar, lo que afecta a los arrecifes pues se altera
el ciclo de los animales que se alimentan de dichos corales y esto produce
reacciones en cadena en el planeta. 2
j. Lee con atención la información
sobre la problemática del rio Atrato y redacta un párrafo amplio sobre unas
posibles soluciones a sus problemas, desde los gobiernos y la comunidad en
general.
Mezclas homogéneas: soluciones
![]() Arroz con verdura* Leche Helado con chocolate Vino
Arroz con verdura* Leche Helado con chocolate Vino
Actividad 2
a. De las imágenes anteriores, ¿cuáles
pueden ser clasificadas como soluciones? ¿Por qué?
|
Imagen |
Por
qué |
|
|
|
b. Seleccione la respuesta correcta:
El cobre, el estaño y el aluminio
poseen propiedades específicas. Cuando se funden pueden formar el bronce de
aluminio que posee composición uniforme. Las proporciones de estos elementos
pueden variar; sin embargo, sus propiedades se conservan. A partir de esta
información el bronce de aluminio son:
a) Un átomo
b) Un elemento
c)Una mezcla homogénea
d)Una mezcla heterogénea
Componentes de
las soluciones
La sustancia que compone la solución
se llama soluto el cual se distribuye uniformemente en otra sustancia llamada
solvente.
El solvente y el soluto no reaccionan
entre sí y se pueden mezclar en distintas proporciones. Por ejemplo, una
pequeña cantidad de sal disuelta en agua proporciona un sabor ligeramente
salado; a medida que se disuelve más sal, el agua sabe cada vez más salada. Por
lo general, la sal (soluto) es la sustancia de la solución presente en menor cantidad,
mientras que el agua en este caso (solvente) es el componente mayoritario. Por
lo tanto, cuando la sal (un soluto y el agua, un solvente, se mezclan, se
obtiene una solución de agua salada.
Las soluciones pueden estar compuestas
de varias proporciones de acuerdo con la cantidad de soluto dado en un
solvente. Por lo tanto, las soluciones pueden variar en concentración. La
concentración de una solución (la concentración se simboliza con corchetes [ ])
es una medida de la cantidad de soluto (sto) disuelto en una cantidad fija de
solución (sln). Cuanto más soluto se disuelva, mayor será la concentración de
la solución.
[ ] en peso (sln) = Cantidad de soluto (sto) gramos ÷ volumen de la solución (litros)
Es decir, la concentración en peso de
una solución es la relación entre la cantidad de soluto en gramos sobre el
volumen de la solución en litros.
Como mencionamos en el ejemplo
anterior, al adicionar más sal al agua se aumentará la concentración de la
solución, y llegará un punto en que la sal no podrá disolverse.
Soluciones diluidas: la cantidad de soluto se encuentra en
una mínima proporción en relación al volumen de la solución.
Soluciones concentradas: la cantidad de soluto en un volumen
determinado es considerable.
Soluciones insaturadas: el soluto no alcanza la cantidad
máxima posible.
Soluciones saturadas: se ha alcanzado la mayor cantidad de
soluto posible para diluir.
Soluciones sobresaturadas: contiene más soluto del que puede
existir para ser diluido.
c. De las siguientes soluciones:
-20 ml de alcohol etílico mezcladas
con 80 ml de agua.
-500 ml de agua con 20 g de sal
disueltas
-80 g de sal en 2 litros de agua. (vol solución:
500ml).
Identifique el soluto y solvente de
cada solución y explique ¿por qué?
d. calcule el % de las soluciones mencionadas
en el punto anterior, tomando como referencia las siguientes relaciones:
Tome como base el siguiente ejemplo:
e. lea el siguiente texto:
¿Qué son las soluciones?
Las soluciones pueden ser una mezcla
de líquidos, sólidos o gases. El latón, por ejemplo, es una solución sólida que
se forma enfriando una mezcla de zinc líquido y cobre líquido. La solución que
resulta tiene el mismo esta- do (sólido, líquido ó gaseoso) que el solvente.
Así, cuando se disuelve sal en agua, la solución de sal resultante es líquida.
El agua carbonatada o refrescos con burbujas se preparan disolviendo dióxido de
carbono gaseoso en agua; el dióxido de carbono es el soluto y el agua es el
disolvente.
La mayoría de las soluciones
biológicamente importantes son aquellas en las cuales los gases, líquidos o
sólidos se disuelven en agua. Estas soluciones se llaman soluciones acuosas en
las que el agua es el disolvente y son importantes para los organismos vivos.
Por ejemplo:
Los microorganismos marinos pasan sus
vidas inmersos en el mar, una solución acuosa.
La mayoría de los nutrientes que las
plantas necesitan están en soluciones acuosas en el suelo húmedo. El plasma, la
parte líquida de la sangre es una solución acuosa que contiene nutrientes y
gases disueltos. Las células corporales existen en soluciones acuosas de fluido
intercelular.
f. Con base en la lectura anterior
complete la siguiente tabla.
De la siguiente lista de soluciones,
¿cuáles son mezclas gas-gas, líquido-gas, sólido-líquido o sólido-sólido?
|
Solución |
Gas-gas |
Líquido-gas |
Sólido-líquido |
Sólido-sólido |
|
Sal disuelta en agua |
|
|
|
|
|
Oro disuelto en mercurio |
|
|
|
|
|
Aleación de zinc y estaño |
|
|
|
|
|
Espuma de afeitar |
|
|
|
|
|
Aire atmosférico |
|
|
|
|
|
Agua carbonatada |
|
|
|
|
Contacto del
docente: Alba Inés Rojas Hurtado
Vía telefónica,
lunes a viernes de 9 a 12 de la mañana 3137985605. Correo electrónico:
rojashurtadoalbaines@gmail.com
Aprendizajes a Desarrollar:
- Predice qué ocurrirá
con una solución si se modifica una variable como la temperatura, la presión o
las cantidades de soluto y solvente.
-Identifica los componentes de una solución y representa cuantitativamente el grado de concentración utilizando algunas expresiones matemáticas: % en volumen, % en masa, molaridad (M), molalidad (m).
-Establece diferencias entre ácidos y bases y describe el carácter ácido o básico de disoluciones de sustancias comunes. Describe algunas relaciones de proporcionalidad que se presentan entre las.
-Asume aptitud de responsabilidad, frente al cumplimiento en la presentación de los trabajos propuestos.
trabajo a realizar:
Expresión
matemática de las soluciones, % volumen/volumen, % masa/masa)
Recuerde que…
El soluto es el componente que se disuelve en
una solución, generalmente se encuentra en menor cantidad y puede estar en
estado sólido, líquido o gaseoso. El solvente es el componente de una
disolución que disuelve al soluto y se encuentra en mayor proporción;
generalmente el agua se reconoce como el disolvente universal, así se encuentre
en menor proporción. El disolvente puede estar en estado sólido, líquido o
gaseoso.
La concentración de las soluciones
De acuerdo con la cantidad
de soluto presente, tendremos soluciones diluidas, saturadas y sobresaturadas. Si bien podemos diferenciar una solución concentrada de una
diluida, no podemos determinar exactamente qué
tan concentrada o diluida está.
A continuación, veremos
cómo se cuantifica la cantidad de soluto presente en una solución, a través del
concepto concentración.
Concentración: la concentración de una solución expresa la cantidad de soluto presente
en una cantidad dada de solvente o de solución. En términos cuantitativos, esto es la relación o proporción
matemática entre la
cantidad de soluto y la cantidad de solvente,
entre soluto y solución.
Esta relación suele expresarse en porcentajes.
https://www.youtube.com/watch?v=puoSrk-aE_E
Ojo!! antes de resolver la actividad, debes observar con mucha atención el video.
Unidades de concentración
Porcentajes referido a la masa: relaciona
la masa del soluto, en gramos,
presente en una cantidad dada de solución.
Teniendo en cuenta que el resultado se expresa como porcentaje de soluto, la cantidad de solución suele tomarse como 100g.
La siguiente expresión resume estos
conceptos
% en masa
del soluto = masa
(g) de soluto *
100 se expresa en % p/p o % m/m
masa (g) de solución
Porcentaje referido al volumen:
se refiere al volumen
de soluto, en ml. presente en cada 100 ml. de solución.
La expresión que se utiliza para calcularlo
es
% en
volumen del soluto = volumen
de soluto * 100 se expresa en % v/v
volumen de solución
Porcentaje masa-volumen: representa la masa de soluto
(en g) por cada 100 ml. de solución. Se puede calcular según la expresión:
Para calcularlo
% masa = masa de soluto * 100 se expresa en % p/v o
% m/v
volumen solución
Actividad 1
Responda las siguientes preguntas
a.
El vinagre es una
disolución acuosa que se forma por la dilución entre ácido acético (CH3COOH) y agua (H2O).
Si se toman 35,4mL de CH3COOH puro
y se mezclan en 250mL de H2O, ¿cuál
es la concentración porcentual volumen - volumen (%v/v) del CH3COOH en H2O?
b.
La cocina de un
restaurante famoso de la ciudad de Quibdó requiere usar 500mL de una disolución
de cloruro de sodio (NaCl)
en agua (H2O) al 10,6%m/m. ¿Cuánto
NaCl deberán agregar para producir dicha disolución?
c.
Calcula el % m/m de
una solución que tiene 6 gramos de soluto en 80 gramos de
Disolución.
d.
Calcula el % m/m de
una solución que tiene 10 g. de soluto y 110 g. de solvente.
e.
Calcula la masa de
soluto que tendría una disolución de 220 g. que es 4% m/m.
f.
Cuantos g. de
soluto y solvente tendrán 320 g. de solución cuya concentración es 5 %
g.
Calcular el %v/v de
170 mL. de dióxido de carbono en una lata de 355 mL. De refresco
h.
la cerveza es una
mezcla de varios ingredientes como agua, malta, levadura, alcohol etílico y
otras especies ¿Qué volumen total de cerveza tiene una lata de 5º y 17?25 mL de
alcohol etílico?
i.
Indicar el volumen
de vinagre que se tiene que disolver en agua para preparar 250 mL de una
disolución al 25 % v/v
Problema de salud pública -
exceso de azúcar en los alimentos
![]()
![]() Las
bebidas gaseosas son, hoy en día, una de las bebidas más consumidas en todo el
mundo, especialmente entre la población joven. El consumo comienza a muy
temprana edad y aumenta durante la adolescencia. Se les conoce en diferentes
países como gaseosas, refrescos, refresco con gas, soda o soft drink. Son
bebidas saborizadas, efervescentes,
sin contenido de alcohol. Estas bebidas representan un problema importante para
nuestra salud, no sólo por lo que contienen, sino también por los alimentos que
desplaza de la dieta. El consumo importante de gaseosas se asocia a una ingesta
más baja de numerosas vitaminas, minerales y fibra. Son un factor de riesgo
importante para la salud en general, ya que contribuyen, sin lugar a dudas, con
el sobrepeso y la obesidad. A su vez, aumentan el riesgo de osteoporosis,
problemas dentales, renales y cardíacos entre otras enfermedades.
Las
bebidas gaseosas son, hoy en día, una de las bebidas más consumidas en todo el
mundo, especialmente entre la población joven. El consumo comienza a muy
temprana edad y aumenta durante la adolescencia. Se les conoce en diferentes
países como gaseosas, refrescos, refresco con gas, soda o soft drink. Son
bebidas saborizadas, efervescentes,
sin contenido de alcohol. Estas bebidas representan un problema importante para
nuestra salud, no sólo por lo que contienen, sino también por los alimentos que
desplaza de la dieta. El consumo importante de gaseosas se asocia a una ingesta
más baja de numerosas vitaminas, minerales y fibra. Son un factor de riesgo
importante para la salud en general, ya que contribuyen, sin lugar a dudas, con
el sobrepeso y la obesidad. A su vez, aumentan el riesgo de osteoporosis,
problemas dentales, renales y cardíacos entre otras enfermedades.
Actividad 2
a.La etiqueta de un refresco o
gaseosa de 750mL indica que su contenido de azúcar es de 60%. De acuerdo con esto, resuelva
la siguiente pregunta.
¿Cuántos gramos de azúcar contiene
una botella de gaseosa de 750mL?
% m/v = masa (g) de soluto * 100
masa (g) de
solución
masa
de soluto = (%m/v) *(volumen de la disolución)
100
Masa de soluto = La gaseosa
contiene g de azúcar
Diluciones
¿Cómo preparar
una disolución?
b. Responda las
siguientes preguntas basado en sus conocimientos.
Cuando el vinilo
(pintura a base de agua) está muy espeso, ¿qué se recomienda agregarle?
![]()
Si el café queda muy cargado
(concentrado) ¿qué se recomienda?
Cuando la sopa se calienta y se seca,
el sabor es un poco más salado. ¿Por qué?
¿Por qué la panela se disuelve más lentamente en agua fría que en agua caliente?
Para pintar una reja se disuelve pintura en gasolina. ¿Cuál es el soluto y cuál es el solvente?
c. Sobre la siguiente imagen, responda:
a) ¿Qué solución contiene mayor
soluto?
b) ¿Cuál es la más concentrada?
c)Cuál es la solución más
diluida?
d)Si todas las muestras tienen el
mismo volumen y el color equivale a gotas de tinta, planee un diseño
experimental que relacione la cantidad de gotas que contiene cada uno de los
tubos. ¿Cuántas gotas agregaría para obtener este resultado?
Para tener en cuenta: La masa de un mol de sustancia, llamada masa molar, es equivalente al peso atómico
o molecular (según se haya considerado un mol
de átomos o de moléculas) expresada en gramos.
El peso
atómico está relacionado con los elementos (PA), este dato se extrae de
la tabla periódica. Ejemplos
PA del
oxígeno= 16 g/mol PA del carbono=
12g/mol PA del nitrógeno= 14g/mol
El peso
molecular está relacionado con las moléculas y compuestos (PM), se
calcula, sumando los pesos atómicos de los elementos que constituyen dicha
molécula o compuesto. Ejemplos
PM CO= PA del
carbono + PA del oxigeno
PM CO= 12+16
= 28g/mol
1 mol de hidróxido de potasio (KOH) es el equivalente en gramos de las
del peso atómico.
1 mol = peso en gramos/peso
molecular.
K (potasio) = 39 g/mol O
(oxígeno) = 16 g/mol H (hidrógeno) = 1 g/mol para un total de 56 g/mol de KOH
PM H2O = 1*2 +16 = 18 g/mol
d. Ejercicios
Calcular el Peso
Molecular del Ácido Clorhídrico (HCl), Ácido Sulfúrico (H2SO4),
Cloruro de Sodio (NaCl), Nitrato de
Plata (AgNO3), Permanganato de Potasio (KMnO4), Hidróxido
de Sodio (NaOH), Hidróxido de Potasio (KOH),
Metano (CH4), Etano (C2H6) y del
Amoniaco (NH3).
A
continuación, relaciono pesos atómicos que debe utilizar.
Hidrógeno (H)= 1 g/mol, Cloro
(Cl)= 35.5 g/mol, Azufre (S)= 32 g/mol, Oxigeno (O)= 16 g/mol,
Sodio (Na)= 23 g/mol, Plata (Ag)= 107.87 g/mol, Nitrógeno (N)=
14 g/mol, Potasio (K)= 39 g/mol, Manganeso (Mn)= 55 g/mol, Carbono (C)= 12 g/mol.
¿Qué es la
Molaridad y como se calcula?
La molaridad o
concentración molar es el número de moles de soluto por litro de solución, lo
cual se puede calcular utilizando las siguientes ecuaciónes:
La
concentración molar puede usarse para realizar conversiones entre la masa o
moles de soluto y el volumen de la solución.
Ejemplo: Calcular la Molaridad de una disolución de 0,250 L en la
que está disueltos 30 gramos de cloruro sódico (NaCl). Datos: pesos atómicos
Na=23, Cl=35,45.
Solución: calculamos el peso molecular del cloruro de sodio (NaCl)
Peso molecular del NaCl = 23 + 35,45 = 58,45 gramos / mol
Calculamos las moles de NaCl, dividiendo la masa en gramos,
entre el peso molecular, que ya calculamos. Así:
Moles de NaCl = masa soluto /
peso molecular = 30 / 58,45 = 0,51 moles
Por último, calculamos la molaridad, haciendo uso de la fórmula:
M= moles de soluto/volumen de la solución, en litros.
Molaridad = moles NaCl /
volumen de disolución = 0,51 / 0,25 litros = 2,04 M
¡¡Practiquemos!!
a.
Calcular la Molaridad de 5 gramos de ácido
sulfúrico (H2SO4) en una disolución de 0,2 L. Datos:
pesos atómicos S=32,1, O=16, H=1
b.
Determinar la Molaridad de una disolución
formada al disolver 12 g de hidróxido de calcio, Ca(OH)2, en 200 g
de agua, H2O. Pesos atómicos: (Ca) = 40 ; (O) = 16 ; (H) = 1
c. Calcular la
Molaridad de una solución de 0,35 L de ácido fosfórico (H3 PO4 ),
que contiene 40 gramos de dicho ácido.
Factores que afectan la
solubilidad
Miscibilidad y
solubilidad
![]() Cuando dos o más
sustancias forman una solución, se dice que son miscibles. Si al mezclarse
forman más de una fase, se dice que son inmiscibles. Los términos miscible y
soluble se usan como sinónimos. Por eso es correcto decir que el agua y la sal
son miscibles o solubles y también que el agua y el aceite son inmiscibles o
insolubles.
Cuando dos o más
sustancias forman una solución, se dice que son miscibles. Si al mezclarse
forman más de una fase, se dice que son inmiscibles. Los términos miscible y
soluble se usan como sinónimos. Por eso es correcto decir que el agua y la sal
son miscibles o solubles y también que el agua y el aceite son inmiscibles o
insolubles.
La solubilidad se
refiere a la máxima cantidad de soluto que se puede disolver en 100 gramos de
solvente una determinada temperatura. ![]() La capacidad de
una determinada cantidad de líquido para disolver una sustancia sólida no es
ilimitada. Añadiendo soluto a un volumen dado de solvente se llega a un punto a
partir del cual la disolución no admite más soluto (un exceso de soluto se
depositaría en el fondo del recipiente). Se dice entonces que está
sobresaturada.
La capacidad de
una determinada cantidad de líquido para disolver una sustancia sólida no es
ilimitada. Añadiendo soluto a un volumen dado de solvente se llega a un punto a
partir del cual la disolución no admite más soluto (un exceso de soluto se
depositaría en el fondo del recipiente). Se dice entonces que está
sobresaturada.
Cuando la solubilidad es superior a 0,1 M (molar), se tiene que la sustancia
es soluble en el disolvente considerado; por
debajo de 0,1 M (molar) se entiende que es poco soluble o incluso como
insoluble si se aleja bastante de
este valor de referencia.
Factores que
afectan la solubilidad en las soluciones
1.Naturaleza del
soluto y del solvente:
![]() La solubilidad es
mayor entre sustancias cuyas moléculas sean análogas, eléctrica y
estructuralmente. Los sólidos iónicos son insolubles en disolventes apolares.
En general son solubles en agua. Cuando existe semejanza en las propiedades
eléctricas de soluto y solvente, las fuerzas intermoleculares son intensas,
propiciando la disolución de una en otra. Como el agua es una molécula polar,
se pueden disolver en ella solutos polares como alcohol, acetona y sales
inorgánicas. Del mismo modo la gasolina, ya que tiene carácter apolar, disuelve
solutos apolares como resinas, aceites y algunos polímeros.
La solubilidad es
mayor entre sustancias cuyas moléculas sean análogas, eléctrica y
estructuralmente. Los sólidos iónicos son insolubles en disolventes apolares.
En general son solubles en agua. Cuando existe semejanza en las propiedades
eléctricas de soluto y solvente, las fuerzas intermoleculares son intensas,
propiciando la disolución de una en otra. Como el agua es una molécula polar,
se pueden disolver en ella solutos polares como alcohol, acetona y sales
inorgánicas. Del mismo modo la gasolina, ya que tiene carácter apolar, disuelve
solutos apolares como resinas, aceites y algunos polímeros.
2.Temperatura:
Generalmente un
aumento de temperatura facilita el proceso de solubilidad de un soluto. Lo que
se explica por:
-El calor
suministrado al sistema aumenta la energía interna y con esto la velocidad de
difusión de las partículas del soluto en el seno del solvente.
-El calor
suministrado es absorbido por las moléculas del soluto, debilitándose las
fuerzas intermoleculares y facilitando el proceso de solubilidad.
3.Presión
Tiene efecto
principalmente sobre los gases siendo proporcional a la solubilidad. Es decir,
a mayor presión, mayor solubilidad. “Los líquidos son prácticamente
incompresibles así que no se ven afectados por la variación de presión”.
4.Superficie de
contacto:
Este factor es
importante en la solubilidad de solutos sólidos en solventes líquidos, ya que
entre más esté finamente dividido sea el sólido, mayor superficie de contacto
existirá entre las moléculas. Es por esto que en algunas situaciones la
trituración de los solutos sólidos facilita la dilución.
Ejemplo: se quema
más rápido la misma madera en viruta (aserrín) que en el bloque de madera.
En la siguiente
gráfica se observa que las sales como nitrato de potasio KNO3, cloruro de
calcio CaCl2, cloruro de potasio KCl aumentan su solubilidad cuando aumenta la
temperatura de la solución. En el cloruro de sodio NaCl, la variación de
temperatura no altera apreciablemente la solubilidad. En otros casos ocurre que
al aumentar la temperatura disminuye la solubilidad como el caso de Sulfato de
Cerio (III), Ce2(SO4)3.
Ojo!! antes de resolver la actividad, debes observar con mucha atención el video.
Realiza en el cuaderno, las preguntas y respuestas, que se formulan en el video.
Valores
de la solubilidad de algunas sustancias en gramos del soluto en 100 gramos de
H2O a 20°C y a 60°C
Tips para resolver:
En la tabla, recuerde que debe tener en cuenta que un valor en gramos por encima a determinada temperatura es una solución sobresaturada. Si está por debajo es insaturada, pero si está en el valor es saturada.
En la gráfica de solubilidad de algunas sales,
todos los valores
en gramos de la sal a una determinada temperatura por encima de la línea de
color de cada sal nos indican una solución sobresaturada, por debajo de la
línea una solución insaturada y sobre la línea, una solución saturada.
Tercera entrega Tercer Periodo
Trabajo para 15 días, del 31 de agosto al 14 de septiembre
Aprendizajes a Desarrollar:
Relaciono los conceptos ácido y base con las
sustancias utilizadas en la vida cotidiana.
Establezco diferencias entre ácidos y bases y describo
el carácter ácido o básico de disoluciones de sustancias comunes.
Asumo actitud de responsabilidad, frente al
cumplimiento en la presentación de los trabajos propuestos.
¿Qué son ácidos y bases?
https://www.youtube.com/watch?v=GaUXNVVFd4g
1.Realizar resumen del video
En
química se llaman ácidos y bases a dos tipos diferentes de sustancias opuestas
entre sí. Cada una de estas sustancias reúne propiedades específicas que
modifican el comportamiento de las soluciones químicas. Tanto ácidos como bases
pueden encontrarse en estado líquido, gaseoso y sólido (el polvo).
Al
juntarse ácidos y bases en una solución, se produce una reacción exotérmica, es
decir, se produce calor. Esta reacción se conoce como neutralización.
¿Qué es un ácido?
Se
llaman ácidos a aquellas sustancias que liberan iones de hidrógeno positivos
(H+) en una solución. Esta definición fue introducida por el científico Svante
Arrhenius.
Otro
concepto, desarrollado por el científico Gilbert Newton Lewis, define los
ácidos como sustancias que pueden recibir o absorber un par de electrones de la
solución.
Como ejemplos de ácidos podemos mencionar los
siguientes:
·
Ácido
acético o CH3COOH (vinagre);
·
ácido
ascórbico o C6H8O6 (vitamina C);
·
ácido
fosfórico o H3PO4 (presente en las bebidas
gaseosas);
·
ácido
láctico o C3H6O3 (producido durante el
ejercicio físico);
·
ácido
cítrico o C6H8O7 (naranjas, toronjas,
limones, mandarinas, etc.).
Características
de los ácidos
Entre
las características o propiedades de los ácidos podemos mencionar las
siguientes:
·
Tienen
capacidad para destruir tejidos orgánicos.
·
Producen
reacciones al interactuar con ciertos metales.
·
Actúan
como conductores de corriente eléctrica.
·
Al
mezclarse con bases producen agua y sal.
·
Son
agrios al gusto.
·
El
pH de los ácidos oscila entre 0 y 7 (donde 7 es neutro).
·
Suelen
ser solubles al agua.
Tipos
de ácidos
·
Ácido fuerte: es aquel que
se cede la mayor parte de sus iones de hidrógeno en solución, lo que quiere
decir que se ioniza con gran facilidad. Por ejemplo, el HCl o ácido
clorhídrico.
·
Ácido débil: al contrario
del anterior, el ácido débil en solución acuosa libera iones H+ en menor
proporción. Por ejemplo, el ácido acético.
¿Qué
es una base?
De
acuerdo a Svante Arrhenius, se llaman bases a aquellas sustancias que pueden
captar iones de hidrógeno en solución o liberan iones negativos, llamados
hidroxilos (OH-).
También
se definen las bases como aquellas sustancias que aportan dos electrones a la
solución, siguiendo la teoría de Gilbert Newton Lewis.
Como ejemplo de bases, podemos mencionar los siguientes:
·
Hidróxido
de sodio o NaOH (soda cáustica);
·
hidróxido
de potasio o KOH (jabón);
·
hidróxido
de aluminio o Al(OH)3 (antiácido estomacal);
·
hidróxido
de magnesio o Mg(OH)2 (leche de magnesia);
·
hidróxido
de calcio o CaOH (cal).
Características
de las bases
Entre
las características o propiedades de las bases podemos mencionar:
·
Deslizan
al tacto cuando se presentan en disolución, es decir, son jabonosos (como la
lejía).
·
No
reaccionan ante el contacto con metales.
·
Son
conductores de corriente eléctrica en disolución.
·
Al
mezclarse con ácidos producen agua y sal.
·
Son
amargos al gusto.
·
El
pH de las bases oscila entre 7 y 14 (donde 7 es neutro).
·
Algunas
bases son insolubles.
Tipos
de bases
En
el ámbito de las bases, se conocen al menos dos tipos elementales:
·
Base fuerte: se refiere a
una variedad de electrolito al que se le atribuye un carácter fuerte y que, por
lo tanto, puede ionizarse totalmente en una solución acuosa. Por ejemplo, la
soda cáustica.
·
Base débil: se refiere a aquellas bases que no se
disocian totalmente en la solución acuosa, de lo que resulta la presencia de un
ion OH más el radical básico. Por ejemplo, el amoníaco o hidróxido de amonio.
Diferencia
entre ácidos y bases
Una
de las diferencias más importantes entre ácidos y bases es que los ácidos
captan electrones de la solución en la que están disueltos, mientras que las
bases los aportan. Asimismo, los ácidos liberan iones positivos de hidrógeno,
mientras que las bases liberan hidroxilos.
Debido
a estas diferencias, ácidos y bases producen efectos diversos en las soluciones
químicas. Por ejemplo, en las pruebas de pH se acostumbra usar papel
tornasolado. El papel tornasolado azul adquiere tonalidades cálidas al contacto
con ácidos, es decir, adquiere tonos rosas o rojos según la intensidad. Por el
contrario, cuando una base reacciona con un papel tornasolado rojizo, este
adquiere tonalidades azules.
Actividad
2.Completa el
siguiente cuadro con las diferencias entre los ácidos y las bases.
|
Ácidos |
Bases |
|
|
|
3. Cuales son las diferencias entre ácidos fuertes y ácidos débiles?
4.Observa las
fórmulas químicas de ácidos y bases y contesta:
¿Qué elemento identifica a los ácidos?
Que elemento o elementos identifican a las bases?
5.Si el médico te indica que tienes problemas de gastritis, que alimentos crees que no podrías consumir?
6. Observa el grafico de PH y elabora
un párrafo sobre lo que interpretas de él.
7.Explique de acuerdo a la teoría de
Brönsted-Lowry.
¿Cuál es el proceso químico que
ocurre en la acidificación de los océanos? Para dar su explicación use la
información de la imagen que aparece a continuación.
8.Didier un
joven estudiante, salía siempre del colegio a casa de su primo, para hacer
tareas. Un día su tío Juan estaba arreglando la batería del carro y de pronto
el ácido que esta contenía se derramó y cayó en una de sus piernas. Ante el
accidente, la esposa de Juan gritó: ¡Lavemos la pierna con agua!
En ese momento Didier recordó que había leído,
que hay ciertos ácidos que no se pueden enjuagar con agua ya que causarían una
lesión mayor. La situación era difícil y era necesario actuar con rapidez.
¿Qué opciones se le
ocurren para solucionar el problema?
9. Comúnmente las
personas se quejan de acidez estomacal.
¿Qué significa esto
para ti?
Como remedio casero utilizan bicarbonato de sodio. ¿Por qué?
¿Qué crees que hace el bicarbonato en el estómago?
https://www.youtube.com/watch?v=PetpXDflN6s
10. Realizar resumen del video.
Cuarta entrega Tercer Periodo
Trabajo del 14 al 28 de septiembre
Aprendizajes a Desarrollar:
-Identifico las funciones químicas inorgánicas, tomando en cuenta el grupo funcional
-Aplico las reglas sistemáticas, para formar y nombrar óxidos
-Realizo los trabajos propuestos y los presento en las fechas pactados.
La lluvia Ácida
La lluvia ácida se origina por una reacción química de algunos óxidos como el dióxido de azufre SO2, y de nitrógeno NO2, cuando son liberados en el aire y entran en contacto con el agua.
Estas sustancias pueden subir muy alto en la atmósfera, donde se mezclan y reaccionan con el agua para formar contaminantes más ácidos, que en conjunto reciben el nombre de lluvia ácida.
Las actividades humanas son la principal causa de la lluvia ácida, generando dichos gases en la atmósfera. Durante las últimas décadas, los humanos han lanzado diferentes productos químicos en el aire, cambiado y alterando la mezcla de gases en la atmósfera. Las plantas de energía liberan la mayor parte del dióxido de azufre, y gran parte de los óxidos de nitrógeno se produce cuando se queman combustibles fósiles, como el carbón. Además, los gases que emanan los automóviles, camiones y autobuses liberan óxidos de nitrógeno y dióxido de azufre en el aire (figura 1).
1.¿Qué estrategias consideras que se pueden implementar en las ciudades para disminuir la emisión de gases contaminantes?
-Explica qué procesos humanos contribuyen a la formación de lluvia ácida.
-¿Cómo se forma la lluvia ácida?
funciones químicas inorgánicas
https://www.youtube.com/watch?v=oxkaCacqKv4
Observar el video con atención y realizar resumen.
Tal vez sientas que esta unidad está un poco alejada de tu vida, pero los compuestos inorgánicos nos acompañan más cerca de lo que crees. En la sal que le pones a tu comida, en el bicarbonato de sodio que agregas a tus pasteles, y hasta en el adorno de cuarzo que alguna vez te colgaste en el cuello.
Todos los compuestos que tengan propiedades químicas y estructuras semejantes formarán parte de una función química. Por ejemplo, óxidos tienen en su estructura por lo menos un átomo de oxígeno, los hidróxidos se caracterizan por la presencia de OH en su estructura. Del mismo modo, los ácidos en solución acuosa, liberan H+.
1. ÓXIDOS
Los compuestos óxidos resultan de la unión de un metal o no metal con el oxígeno. Se clasifican en óxidos básicos u óxidos metálicos, y óxidos ácidos u no metálicos. En la figura 2 se observan ejemplos de este tipo de compuestos, en color azul se resalta el elemento Oxígeno, estos compuestos se nombran anteponiendo la palabra óxido.
Ejemplos de óxidos:
MgO Óxido de magnesio
BaO Óxido de bario
K2O Óxido de potasio
ZnO Óxido de Zinc
AL2O3 Óxido de aluminio
Para nombrar lo óxidos se puede emplear la nomenclatura sistemática o de Stock
2.Tomando en cuenta el ejemplo anterior, formar óxidos, con los siguientes elementos:
Fe +
Li +
Ca +
Cu +
Na +
Cl +
Br +
Nomenclatura tradicional:
Antes de leer, observa los videos con atención, para que se facilite la comprensión de las reglas de nomenclatura.
https://www.youtube.com/watch?v=pkgWJDoVnBU
Este tipo de nomenclatura nombra inicialmente la palabra óxido seguida del elemento metálico teniendo en cuenta el número de valencia.
•Una valencia
Óxido + nombre del elemento Na+1 + O-2 » Na2O: óxido de sodio
Ca+2 + O-2 » Ca2O2 » CaO: óxido calcio
•Dos valencias
Menor valencia: Óxido + Sufijo oso
Ni+2 + O-2 » Ni2O2 » NiO: óxido niqueloso Hg+1 + O-2 » Hg2O: óxido mercurioso Mayor valencia: Óxido + Sufijo ico
Ni+3 + O-2 » Ni2O3: óxido niquélico
Hg+2 + O-2 » Hg2O2 » HgO: óxido mercúrico
•Tres valencias
Menor valencia: Óxido prefijo hipo + Sufijo oso Cr+2 + O-2 » Cr2O2 » CrO: óxido hipocromoso Valencia intermedia: Óxido + Sufijo oso
Cr+3 + O-2 » Cr2O3: óxido cromoso
Mayor valencia: Óxido + sufijo ico
Cr+6 + O-2 » Cr2O6 » CrO3: óxido crómico
•Cuatro valencias
Primera valencia: Óxido prefijo hipo + sufijo oso Mn+2 + O-2 » Mn2O2 » MnO: óxido hipomanganoso Segunda valencia: Óxido + sufijo oso
Mn+3 + O-2 » Mn2O3: óxido manganoso
Tercera valencia: Óxido + ico
Mn+4 + O-2 » Mn2O4 » MnO2: óxido mangánico Cuarta valencia: Óxido prefijo per + sufijo ico Mn+7 + O-2 » Mn2O7: óxido permangánico.
https://www.youtube.com/watch?v=qQuzUVfnJ1M
En la tabla periódica se pueden diferenciar los grupos metálicos y los no metálicos, como base para determinar si se trata de un óxido básico (metálico) u óxido ácido (no metálico).
En la figura 3 se especifica cada sección de la tabla periódica.
|
Óxidos
ácidos |
Óxidos
básicos |
|
|
|
Plan de mejoramiento Tercer Periodo
PLANES DE MEJORAMIENTO
De acuerdo a lo establecido en el decreto 1290 y en el sistema de
evaluación institucional los estudiantes que presenten desempeño bajo en una
asignatura deben presentar un plan de mejoramiento, teniendo en cuenta lo
siguiente:
|
Nombre
del estudiante |
|
Grado |
9 |
|
|
Período
|
tercero |
Asignatura |
Biología |
|
|
Docente |
Alba Inés Rojas Hurtado |
|||
|
Competencias |
·
Comprender las
relaciones que existen entre las características macroscópicas y
microscópicas de la materia y las propiedades físicas y químicas de las sustancias
que la constituyen. ·
Aplicar los
conceptos químicos en la protección y conservación del medio ambiente y los
recursos naturales, en el hogar, escuela y comunidad, a fin de alcanzar un
comportamiento amigable con el medio ambiente.
|
|||
|
Aprendizajes
del periodo (el estudiante debe desarrollar los reportados en el boletín) |
·
Identifico las
funciones químicas inorgánica, tomando en cuenta el grupo funcional. ·
Aplico las reglas
de nomenclatura, para formar y nombrar óxidos ·
Asume aptitud de
responsabilidad en la presentación de trabajos propuestos, en las fechas
estipuladas. ·
Reconozco la
importancia del cuidado de los recursos naturales.
|
|||
|
Descripción de la dificultad
para alcanzar el/los aprendizaje/s |
Dificultad para realizar las
lecturas y resolver ejercicios e interrogantes planteados. Dificultada para cumplir con
las labores académicas programadas y presentarlas en las fechas pactadas.
|
|||
|
Estrategia de mejoramiento |
Lectura detallada del material
propuesto y solución de las actividades planteadas. Presentación del trabajo
en la fecha estipulada.
|
|||
|
Actividades y fechas de entrega |
Desarrollo y presentación del trabajo propuesto. Fecha de entrega: 26 de octubre
|
|||
FIRMA PADRE DE FAMILIA: ________________________________________________________________________
FIRMA DEL ESTUDIANTE:
________________________________________________________________________
Meteorización química
Una de las razones es que las rocas parecen tan
variadas en su apariencia, se debe a que son sometidas a la erosión química,
que es el proceso por el cual las rocas se descomponen por reacciones químicas,
gracias a la presencia de compuestos como el agua, el oxígeno, el dióxido de
carbono y ácidos puede alterar los minerales que se encuentran en las rocas.
Es la descomposición química de una sustancia cuando se combina con agua. Puede recuperar este término al recordar que el prefijo
«hidro ‘significa’
agua ‘y el sufijo’ lisis ‘significa’ a romper.”
Oxidación
La oxidación es la reacción de una sustancia con el
oxígeno. Es el proceso que causa la oxidación de los automóviles y de otros
elementos que metales, de igual forma se oxidan las rocas que contienen hierro.
Cuando el hierro reacciona con el oxígeno, se forma
óxido de hierro, que no es muy fuerte. Por eso, cuando una roca se oxida,
Figura 28. Oxidación de la roca se debilita y se desmorona con
facilidad (figura 28).
Carbonatación
Consiste en la capacidad del dióxido de carbono para actuar por sí mismo, o
para disolverse en el agua y formar ácido carbónico en pequeñas cantidades. El
agua carbonatada reacciona con rocas cuyos minerales predominantes sean calcio,
magnesio, sodio o potasio, dando lugar a los carbonatos y bicarbonatos (Figura
29).
Lluvia Ácida
La lluvia ácida tiene un efecto directo en las rocas de piedra caliza que
se producen en el suelo, por debajo del suelo y en edificios. La piedra caliza
está compuesta principalmente de calcita, que es un mineral de carbonato de
calcio. El carbonato de calcio reacciona con la lluvia ácida y se disuelve en
solución. Los componentes de piedra caliza también pueden reaccionar con la
lluvia ácida para formar cristales minerales de yeso.
Figura 30.Roca caliza. Efectos de la
lluvia ácida en rocas
Meteorización biológica
Los ácidos producidos por líquenes son un ejemplo de este tipo de
meteorización, los componentes minerales de las rocas pueden ser descompuestos
por la acción de sustancias liberadas por organismos vivos, tales como ácidos
nítricos, amoniacos y dióxido de carbono, que potencian la acción erosiva del
agua
Figura 31. Meteorización biológica
1. 1.La erosión química
consiste en: __________________________________________________________________________
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
2. 2.Redacta las pistas y
construye un crucigrama con los siguientes conceptos: meteorización, hidrólisis,
oxidación, carbonatación, lluvia ácida, agua, dióxido de carbono, oxigeno,
roca.
1. 3. Completa el mapa conceptual con los contenidos de los procesos de
meteorización y sus cinco formas características, agregando ejemplos.
1.
Completar la
siguiente tabla:
|
Compuesto |
Stock |
Sistemática |
Tradicional |
|
Ag2O |
|
|
|
|
|
Oxido de Antimonio (III) |
|
|
|
|
|
Monóxido de estaño |
|
|
|
|
|
Oxido hipovanadioso |
2. s:66.Estas son características de los óxidos:
a.________________________________________________________________________
b.________________________________________________________________________
c.________________________________________________________________________
d.________________________________________________________________________
e.________________________________________________________________________
|
Óxidos Básicos |
Óxidos Ácidos |
|
|
|
Aprendizajes a Desarrollar
-Reconozco la importancia del cuidado de los páramos.
-Identifico las características del páramo de
Santurbán y su importancia ecológica.
-Aplico las reglas para formar y nombrar hidróxidos.
-Demuestro mi responsabilidad, realizando y presentando
los trabajos en las fechas estipuladas.
El
páramo de Santurbán
El Páramo Santurbán es un macizo montañoso, conocido
geográficamente también como "Nudo de Santurbán", que contempla una
amplia región natural, de ecosistema montano intertropical, con ubicación en
los departamentos colombianos de Norte de Santander.
El páramo se destaca por la diversidad y belleza de su fauna, así
como por su importancia ecológica, en el que nacen varias fuentes hídricas que
abastecen de agua a poblaciones y ciudades de la región. Los páramos en
Colombia están protegidos constitucionalmente (Artículos 9, 79, 80, y numeral 8
del Artículo 95 de la Constitución de Colombia de 1991), "Las zonas de
páramos, subpáramos, los nacimientos de agua y las zonas de recarga de
acuíferos serán objeto de protección especial."
1. 1. Diseña un
cartel con un mensaje de cuidado y defensa de los páramos en Colombia:
|
|
La importancia del páramo de Santurbán para Colombia
Este ecosistema tiene una extensión de 129.743 hectáreas, existen
ricos minerales como oro, plata, cobre y, adicionalmente, es el páramo que
surte directamente de agua a 2.5 millones de personas en departamentos como
Santander, Norte de Santander, Boyacá y César.
Según un estudio de Corpoboyacá, hay que tener en cuenta que los
páramos son indispensables para la mitigación del cambio climático ya que una
hectárea de páramo protegido puede capturar hasta 200 toneladas de CO2 al año.
Esto quiere decir que la extensión del Páramo de Santurbán podría ayudar a
Colombia a capturar casi 26 millones de toneladas al año.
Por otro lado, el ecosistema del Páramo de Santurbán es hábitat de 457 especies de plantas, 17 de anfibios, 17 de reptiles, 201 de aves y 58 de mamíferos. Todos estos elementos han hecho que la Corte Constitucional de Colombia revise la importancia de proteger este tipo de entorno.
2. Lee con atención el contenido del texto sobre los páramos y responde:
Es importante cuidar los páramos porque:
_________________________________________________________________________
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
3.Observo las fotos y descubro que las características del páramo de Santurbán son: ____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
4. Leo los mensajes impresos en las fotos del páramo y escribo una reflexión sobre cada uno:
|
¿Minería
en los páramos? ¿Cianuro
en nuestra agua?
|
Nuestro
oro es el agua. |
Por
el agua, por la vida y por los ecosistemas… |
Hidróxidos o bases
5. observa con atención el video y escribo 5 ideas fundamentales
https://www.youtube.com/watch?v=T7bRhPA413E
Los hidróxidos son compuestos iónicos formados por un metal (catión) y un elemento del grupo hidróxido (OH-) (anión). Se trata de compuestos ternarios aunque tanto su formulación y nomenclatura son idénticas a las de los compuestos binarios.
1. 6.Tomando en
cuenta los ejemplos anteriores, formar los hidróxidos a partir de los
siguientes metales y nombrarlos:
Na + OH
Ca + OH
Li + OH
Fe + OH
K + OH
Cu + OH
2. 7.Seleccionar 5
elementos metálicos de la tabla periódica, formar los respectivos hidróxidos y
nombrarlos.
_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Fórmula de los hidróxidos
La fórmula general de los hidróxidos es del tipo X (OH)n, siendo n
el número de iones igual que el número de oxidación del catión metálico, para
que la suma total de las cargas sea cero.
![]() Ejemplo:
Óxido de Magnesio + Agua Hidróxido de Magnesio
Ejemplo:
Óxido de Magnesio + Agua Hidróxido de Magnesio
En la figura 10 se especifica la ubicación del número de oxidación
de los elementos en la tabla periódica, tomando como ejemplo el Estaño Sn.
¿Qué
es el número de oxidación?
1. Es la cantidad de electrones que tiende a perder o ganar un
átomo en una reacción química con otros átomos, para poder adquirir estabilidad
química.
2. El número de oxidación es positivo si el átomo pierde
electrones, o los comparte con un átomo que tenga la posibilidad de recibirlos.
3. El número de oxidación será negativo cuando el átomo gane
electrones, o los comparta con un átomo que tenga tendencia a cederlos.
Para establecer el nombre de los hidróxidos se utiliza la nomenclatura sistemática, la tradicional y la de stock, estos tres tipos se describen a continuación.
Nomenclatura tradicional
La nomenclatura tradicional comienza con la palabra hidróxido
seguido del elemento teniendo en cuenta la valencia con la que actúa:
• Una valencia: Hidróxido + nombre del metal
Mg+2 + (OH)-1 = Mg (OH)2:
hidróxido de magnesio
• Dos valencias:
Menor valencia: Hidróxido sufijo oso
Pt+2 + (OH)-1 = Pt (OH)2: hidróxido platinoso
Mayor valencia: Hidróxido sufijo ico
Pt+4 + (OH)-1 = Pt (OH)4:
hidróxido platínico
• Tres valencias:
Menor valencia: Hidróxido prefijo hipo sufijo oso
Zr+2 + (OH)-1 = Zr (OH)2:
hidróxido hipocirconioso
Valencia intermedia: Hidróxido sufijo oso
Zr+3 + (OH)-1 = Zr (OH)3:
hidróxido circonioso
Mayor valencia: Hidróxido sufijo ico
Zr+4 + (OH)-1 = Zr (OH)4:
hidróxido circónico
• Cuatro valencias:
Primera valencia (baja): Hidróxido prefijo hipo sufijo oso
V+2 + (OH)-1 = V (OH)2:
hidróxido hipovanadoso
Segunda valencia: Hidróxido sufijo oso
V+3 + (OH)-1 = V (OH)3:
hidróxido vanadoso
Tercera valencia: Hidróxido sufijo. ico
V+4 + (OH)-1 = V (OH)4:
hidróxido vanádico
Cuarta valencia (alta): Hidróxido prefijo per sufijo ico
V+5 + (OH)-1 = V (OH)5:
hidróxido pervanádico
Nomenclatura de stock
En la nomenclatura de stock comienza con la palabra hidróxido,
seguido del elemento metálico con la valencia del mismo en números romanos
entre paréntesis.
IMPORTANTE: cuando el elemento metálico sólo tenga una valencia no se indica en números romanos la valencia.
Ejemplos:
HgOH: hidróxido de mercurio (I)
Sn(OH)2: hidróxido de estaño (II)
Nomenclatura sistemática
En la nomenclatura sistemática se anteponen los prefijos numéricos
a la palabra hidróxido.
Ejemplos:
Be (OH)2: dihidróxido de berilio
Sn (OH)4: tetrahidróxido de estaño
8.Escribe el nombre de los siguientes hidróxidos utilizando el sistema de stock y la nomenclatura sistemática.
Nota: previamente debe estudiar las reglas expuestas, con sus respectivos ejemplos
|
Formula del hidróxido
|
Nomenclatura tradicional |
Nomenclatura Stock |
|
Fe(OH)3
|
|
|
|
Sn(OH)4
|
|
|
|
AgOH
|
|
|
|
Ni(OH)2
|
|
|
|
Ca(OH)2
|
|
|
|
KOH
|
|
|
|
LiOH
|
|
|
9.las principales características de los hidróxidos son:___________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Segunda Entrega Cuarto Periodo
Del 30 de octubre al 15 de noviembre
Aprendizajes
-Describo las características y diferencias de las
diversas funciones químicas inorgánicas.
-Identifico y nombro compuestos químicos haciendo
uso correcto de las reglas de nomenclatura estudiadas aplicables en la vida cotidiana.
-Argumento las causas de la contaminación ambiental.
- Reconozco las características fundamentales de los
ácidos inorgánicos.
-Presento los trabajos propuestos en las fechas
pactadas, con buena calidad.
Una preocupación ambiental
Realizar resumen del video:
https://www.youtube.com/watch?v=1aYPh7cQkRU
Iniciada la década correspondiente a los años 60, la comunidad científica empezó a preocuparse por los altos índices de deforestación y contaminación de las fuentes hídricas a nivel mundial.
Una de las investigaciones más importantes al
respecto, fue la realizada en el año de 1963 por el botánico F. Herbert
Bormann, el ecólogo forestal Gene Likens y sus colegas. Su principal inquietud
era: ¿Qué consecuencia tiene la deforestación en la pérdida de agua y
nutrientes en un ecosistema?
Para dar respuesta a su pregunta, los
investigadores establecieron dos lugares de estudio. El primero de ellos lo
llamaron lugar de control, el cual
consistía en un ecosistema de bosque vírgen. El segundo lo denominaron lugar experimental, el cual consistía en
un ecosistema con árboles talados. En los dos lugares adecuaron un mecanismo
que permitía medir la cantidad de agua y de nutrientes vegetales disueltos que
entraban y salían de una y otra zona.
Estas mediciones mostraron que el suelo de un
bosque maduro vírgen almacena agua y retiene nutrientes químicos de forma muy
eficiente.
De los resultados obtenidos en la zona lugar experimental, los investigadores
determinaron que dada la ausencia de plantas que ayudaran a absorber y retener
agua, la cantidad de líquido que salió del valle deforestado fue entre un 30% y
40 % mayor. Adicionalmente, como resultado de la eliminación de todos los
arbustos, se perdieron entre 6 y 8 veces más nutrientes que en el bosque vírgen
del primer experimento porque esa gran cantidad de agua que corría rápidamente
sobre el terreno, erosionó el suelo y expulsó los nutrientes disueltos del
lugar.
1.Con base en lo que leyó, responda:
a. ¿Cuál fue la problemática que motivó la investigación?
b. ¿Cuál es la pregunta de investigación?
c. ¿Cuáles son las variables existentes en las zonas estudiadas?
|
Característica que variaron los
investigadores
|
Características que no variaron los
investigadores |
|
|
|
d. ¿Qué hipótesis se podrían plantear?
e. ¿Contribuye usted con la deforestación y la contaminación del agua?
Conteste sí o no a las preguntas de la siguiente encuesta de acuerdo con
sus actividades de la vida cotidiana. El objetivo es determinar si usted
practica acciones que contribuyen a la deforestación y la contaminación del
agua.
|
Preguntas
|
SI |
NO |
|
1. ¿Cierra la llave del agua mientras se
cepilla los dientes, se enjabona las manos o el cuerpo, o se aplica shampoo? |
|
|
|
2. ¿Reutiliza las hojas que arranca de su
cuaderno? |
|
|
|
3. ¿Escribe por lado y lado de las hojas? |
|
|
|
4. ¿Deposita toda tu basura dentro de las
canecas, evitando arrojar residuos a la calle?. |
|
|
|
5. ¿Evita arrojar residuos de papel higiénico
y otros objetos al sanitario? |
|
|
|
6. ¿Evita arrojar al sifón residuos de
pintura, aceite o limpiadores fuertes? |
|
|
|
7. ¿Arroja basura en los ríos, lagos o en el
mar? |
|
|
|
8. ¿Cuando se baña,
utiliza abundante jabón y/o shampoo? |
|
|
|
9. ¿Recoge los
residuos de su mascota? |
|
|
|
10. ¿Separa la basura
en residuos orgánicos no reciclables y residuos inorgánicos reciclables? |
|
|
Interpretación de resultados: Si contestó no a cinco o más preguntas, usted contribuye al aumento de la deforestación y la contaminación.
f. ¡Cambie sus hábitos y trabajemos juntos por
un planeta más sano!
Construye una frase
similar a la anterior, convocando al cuidado de medio ambiente.
LOS ÁCIDOS
Realizar resumen y extraer 5 ideas fundamentales:
https://www.youtube.com/watch?v=Sj_B9T6Y82I
Un ácido es considerado tradicionalmente como cualquier compuesto
químico que, cuando se disuelve en agua, produce una solución con una actividad
de catión hidronio mayor que el agua pura, esto es, un pH menor que 7.
Existe una gran cantidad de ácidos. El ácido
acético, por ejemplo, es un líquido incoloro y de olor picante, que se
produce a través de la oxidación del alcohol etílico y se utiliza en la
síntesis de productos químicos.
Tampoco podemos obviar la existencia del ácido
sulfúrico que es aquel que se obtiene a partir de dióxido de azufre. La fórmula
de este citado compuesto químico es H2 SO4 y se estima que es uno de los de los
elementos de este tipo que más se crea en el mundo pues se utiliza con mucha
frecuencia en el ámbito industrial, y especialmente en lo que es la elaboración
de fertilizantes.
Su capacidad corrosiva es una de las principales señas
de identidad que tiene este ácido que además se identifica por el hecho de que
actúa de manera muy violenta en su contacto con el agua, tanto es así que
siempre se recomienda tener cuidado extremo a la hora de trabajar y operar con
él para evitar quemaduras, entre otros factores.
El ácido acrílico es soluble en agua,
forma polímeros con facilidad y se aplica en la producción de materiales
plásticos y pinturas.
El ácido benzoico, en cambio, es un sólido
que se utiliza en farmacias. Otro ácido sólido es el bórico, con
usos antisépticos e industriales.
Hay ácidos que son gases, como el clorhídrico,
formado por cloro e hidrógeno. Se trata de una sustancia corrosiva, que se
obtiene a partir de la sal común y que suele usarse disuelto en el agua.
El ácido cítrico, por otra parte, es aquel
que contienen varios frutos, como el limón. Tiene un sabor agrio y es muy
soluble en agua.
El ácido desoxirribonucleico es el
que compone el material genético de las células y presenta, en su secuencia,
la información para la síntesis de proteínas.
Asimismo, dentro del ámbito de la salud tenemos que
subrayar la existencia de otros ácidos fundamentales. Este sería el caso, por
ejemplo, del llamado ácido úrico que es un compuesto orgánico que surge de la
suma del hidrógeno, el nitrógeno, el carbono y el oxígeno. Más concretamente
podemos establecer que es un residuo de desecho del cuerpo de todo ser humano
que se encuentra en la orina y que en función de los niveles que existan de él
un hombre puede sufrir problemas de gota o de cálculos renales.
Y todo ello sin olvidar tampoco el conocido como ácido
fólico, al que conocemos como vitamina B9. Es fundamental que todo hombre o
mujer cuenta con los niveles necesarios de aquel pues en caso contrario puede
sufrir depresión o enfermedades cardíacas, entre otras patologías.
La desinfección (ácido fénico, ácido
salicílico), el grabado de vidrio (ácido fluorhídrico) y la
tintorería (ácido tartárico) son otras de las aplicaciones que se les
otorga a los distintos ácidos existentes
Los ácidos inorgánicos pueden ser de dos tipos:
Hidrácidos:
Un ácido hidrácido o
sencillamente hidrácido, es un ácido que no contiene oxígeno, es un compuesto
binario formado por hidrógeno (H), un elemento no-metálico y un halógeno, este
grupo de elementos se señalan de color rojo en la figura 7 de la tabla
periódica y está constituido por: flúor F, cloro Cl, bromo, yodo I y Astato At
(figura 8).
2. Suma al hidrogeno, el respectivo halógeno y forma el ácido
hidrácido correspondiente:
(resaltados en la tabla periódica)
H +
H +
H +
H +
Oxácidos
Son sustancias constituidas por oxígeno, hidrógeno y otro elemento
no metálico, son sustancias con bajas temperaturas de fusión y de ebullición y
en general son solubles en agua. Un ejemplo de los oxácidos es la formación del
ácido sulfúrico. (Figura 7). El nombre del compuesto formado tiene el sufijo
ico.
3. Realiza un mapa conceptual con los ácidos relacionados en el
texto anterior:
4. toma en cuenta la imagen y resuelve los ejercicios propuestos:
Suma a los siguientes óxidos el agua (H2O) y forma el respectivo ácido oxácido (no olvide simplificar, cuando corresponda)
N2O5
Cl2O
Cl2O3
Cl2O5
Cl2O7
CO
B2O3
SO3
P2O5
5. Relacionen por medio de una línea los siguientes compuestos con
su respectivo nombre.
Ácido sulfúrico H2 O
Ácido fluorhídrico HBO2
Ácido bórico H2
SO4
Ácido fosfórico HI
Ácido sulfhídrico HBr
Ácido bromhídrico H3 PO4
Ácido nítrico
HBrO3
Ácido yodhídrico
HCl
Ácido clorhídrico
HNO3
Ácido brómico HF
6. Después de
organizar los compuestos con su respectivo nombre, escriba cuáles pertenecen a
hidrácidos y a oxácidos:
|
Ácidos
Hidrácidos |
Ácidos
Oxácidos |
|
|
|
Tercera entrega Cuarto periodo
del 15 al 23 de de noviembre
Aprendizajes
-Describo las características y diferencias de las
diversas funciones químicas inorgánicas.
-Nombro correctamente las sales inorgánicas,
apropiando las reglas de nomenclatura IUPAC.
-Empleo conceptos teóricos para formar sales
inorgánicas.
-Asumo una actitud consecuente con el cuidado del
medio ambiente.
-Presento los trabajos propuestos en las fechas
pactadas, con buena calidad.
Impacto ambiental del crecimiento
demográfico
https://www.youtube.com/watch?v=B2yyFDApWZk
Existen en el Mundo más de 7 mil millones de persona,
quienes requieren de alimento, agua, vestido y vivienda para sobrevivir, estas
necesidades básicas son cubiertas gracias a los recursos naturales que se
obtiene de la Tierra, sin embargo, el crecimiento demográfico ha implicado una
sobreexplotación que ha llevado al Planeta a rebasar su capacidad.
Se consumen recursos naturales más rápido de lo que se
pueden volver a generar y se desechan residuos más rápido de lo que pueden ser
absorbidos. El medio ambiente tarda 18 meses en recuperarse de lo que los seres
humanos gastan y desechan en un año.
El sistema para medir el impacto que tiene la
presencia del ser humano y sus actividades sobre el planeta se encuentra la
huella ecológica. El concepto surgió en la década de 1990 como propuesta del
ecólogo William Rees y de su compañero Mathis Wackernagel para medir el impacto
que tenía el ser humano sobre la Tierra, así como la capacidad que éste tiene
para cubrir las necesidades de los seres vivos que la habitan.
El organismo internacional World Wildlife Fund, (WWF),
define a la huella ecológica como: “El impacto de una persona, ciudad o país,
sobre la Tierra, para satisfacer lo que consume y para absorber sus residuos”.
De acuerdo con la organización GloblalFootprint
Network la huella ecológica de cada ser humano está calculada en 2.6 hectáreas,
pero el planeta sólo es capaz de dar 1.8 hectáreas a cada habitante.
Existe una diferencia en el tamaño de huella ecológica
de acuerdo a cada país, en algunos lugares del Mundo se consumen por encima de
lo corresponde a cada habitante y en otros no llega a ser lo necesario para
cubrir las necesidades básicas. Por ejemplo, Estados Unidos tiene una huella
ecológica de 9 hectáreas por persona, mientras que la de Haití sólo llega a
media hectárea.
El incremento demográfico implica directamente el
aumento de consume de recursos naturales, así como fuentes de contaminantes,
siendo la sobreexplotación de ecosistemas, extracción del agua y contaminantes atmosféricos
algunos de los principales problemas ambientales.
Sobre explotación de ecosistemas
En este tema resalta la cantidad de tierras fértiles destinadas a la
agricultura y ganadería que han generado una sobre explotación de suelos; la
Organización de las Naciones Unidas para la Agricultura y la Alimentación
(FAO), en período 2000-2005, estimó que mundialmente al año se pierden 7.3
millones de hectáreas de bosques y selvas, lo equivalente al estado de Baja
California por estas actividades.
Extracción de agua
El agua es el recurso natural cuya escases genera mayor preocupación a nivel
internacional ya que su consumo resulta indispensable para la supervivencia de
los seres vivos. Una persona puede sobrevivir sin consumir alimentos por un
largo tiempo sin embargo no lo logra si lo que le falta es agua.
La Tierra posee 400 millones de km³ de agua, pero sólo
el 2.5% se considera potable, de la cual el 70% se encuentra en glaciares por
lo que no está disponible, dejando un 0.3% de líquido para consumo humano.
Actividad
1. Que problema ha traído el crecimiento demográfico?
2. Que entiende por huella ecológica?
3. Puedo contribuir para que el problema de la explosión demográfica se reduzca?
4. Que puede ocurrir, si la población sigue creciendo en el mundo de manera desmedida?
Las
Sales
Realizar resumen del video
Se forman entonces por la unión de un catión metálico con diversos
grados de oxidación o valencia
positiva, con un anión no metálico con grados de oxidación o
valencia negativa, por ejemplo:
Na+ Cl- Fe2+
S-2
La valencia negativa también puede provenir de un anión que
contiene oxígeno.
Ejemplo: el ácido nítrico HNO3, pierde su catión H+, por esto se
convierte en el anión NO3-1
Que posteriormente se combina con el catión K+1 que ha perdido su
anión OH-1,
El anión OH-1 se combina con el H+ para formar H2O.
Las sales se forman con la combinación de un ácido y un hidróxido
y como producto secundario se forma agua, como se ilustra en el siguiente
ejemplo: HCl + NaOH → NaCl + H2O
5.Tomando en cuenta el ejemplo anterior, completa las
siguientes reacciones:
H2SO4 + Fe(OH)3 →
H2SO4 + NaOH →
H2CO3 + NaOH →
HNO3 + Cu(OH)2 →
HNO3 + Ca(OH)2 →
Tipos de sales
Sales haloideas o haluros
Resultan de la combinación de un hidrácido con una base, en la
cual resulta como producto la formación de agua. Se mantienen la norma de
escribir primero el metal e inmediatamente el no metal. Se tienen en cuenta los
números de oxidación para la escritura de la formula y para el nombre del
compuesto.
6) Escribir la fórmula de los
siguientes compuestos:
Fosfuro de magnesio:
Carburo cálcico:
Bromuro áurico, o bromuro de oro (III):
Arseniuro sódico:
Ioduro cádmico:
Seleniuro niquélico, o seleniuro de niquel (III):
Cloruro cobaltoso, o cloruro de cobalto (II):
Floruro mercurioso, o fluoruro de mercurio (I):
7) Escribir el nombre de los
siguientes compuestos
PtBr2
Ag2S
FeCl3
MnF2
NaI
CaS
AlN
Zn3N2
Ni4C3
CaF2
Oxisales
Realizar resumen del video.
Las oxisales son sales que se caracterizan
por la presencia de oxígeno, y al resultar de la combinación de un ion de un
oxácido con una base, pueden ser consideradas como sales neutras. En su fórmula
se escribe de igual manera el metal y luego el ion proveniente del ácido
oxácido: no metal y oxígeno. El número subíndice que acompaña al metal proviene
del número de hidrógenos del ácido.
8) Escribir la fórmula de los
siguientes compuestos
dioxoclorato (III) de sodio:
sulfito de potasio:
bromato de berilio:
fosfato de cobalto (III):
tetraoxosulfato (VI) de potasio:
9) Escribir el nombre de
los siguientes compuestos
NaClO:
Cs2SO3:
Na3PO4:
LiNO3:
FeCO3:
Sales básicas y acidas
Las sales donde ocurren neutralizaciones parciales y que pueden presentar características ácidas o básicas debido a la presencia de iones multivalentes se conocen como ácidas o básicas según la presencia de H o grupos OH respectivamente.
• Sales ácidas estas resultan de la sustitución parcial de hidrógenos del ácido por el metal. Su fórmula se escribe.
Importante: para nombrarlas se agrega la palabra ácido después del nombre del ion. Ejemplo:
|
Ácido |
|
Base |
|
Sal |
|
Agua |
|
H3PO4(ac) |
+ |
NaOH(ac) |
|
NaH2PO4 |
+ |
H2O (l) |
|
Ácido fosfórico |
|
Hidróxido de sodio |
|
Fosfato díacido de sodio |
|
Agua |
|
H3PO4 |
+ |
2NaOH(ac) |
|
Na2HPO4(ac) |
+ |
2H2O(l) |
|
Ácido fosfórico |
|
Hidróxido de sodio |
|
Fosfato ácido de sodio |
|
Agua |
|
H3PO4(ac) |
+ |
3NaOH(ac) |
|
Na3PO4(ac) |
+ |
3H2O (l) |
|
Ácido fosfórico |
|
Hidróxido de sodio |
|
Fosfato sodio |
|
Agua |
|
Sal
Ca(OH)NO3 Al(OH)SO4 Cu2(OH)2SO4 |
|
Nombres |
Nitrato básico de calcio |
sulfato básico de aluminio |
sulfato dibásico de cobre (II) |
|
Hidróxido - nitrato de calcio |
hidróxido-sulfato de
aluminio |
dihidróxido-sulfato de cobre (II) |
|
|
hidroxitrioxonitrato (V)
de calcio |
hidroxitetraoxosulfato (VI) de aluminio |
dihidroxitetraoxosulfato (VI) de cobre (II) |
hidrogenosulfato de hierro(II):
dihidrogenofosfato de calcio:
monohidrogenofosfato de aluminio:
hidrogenocarbonato de sodio:
hidrogenosulfato de escandio:
11) Escribir el nombre de los siguientes compuestos:
Ba(H2PO4)2:
Ca(HSO3)2:
LiHCO3:
CaHPO4:
Ba(HS)2:
12) Escribir la fómula de los siguientes compuestos:
hidroxinitrato de zinc:
hidroxiyodato de cobre (II):
hidroxicloruro de magnesio:
dihidroxisulfato de cobre (II):
dihidroxitris(carbonato) de magnesio:
13) Escribir el nombre de los siguientes compuestos:
Cu2Cl(OH)3:
Pb(NO3)(OH):
Al2(OH)4(SO4):
Ni (OH):
14)Realizar un mapa conceptual con las clases de sales
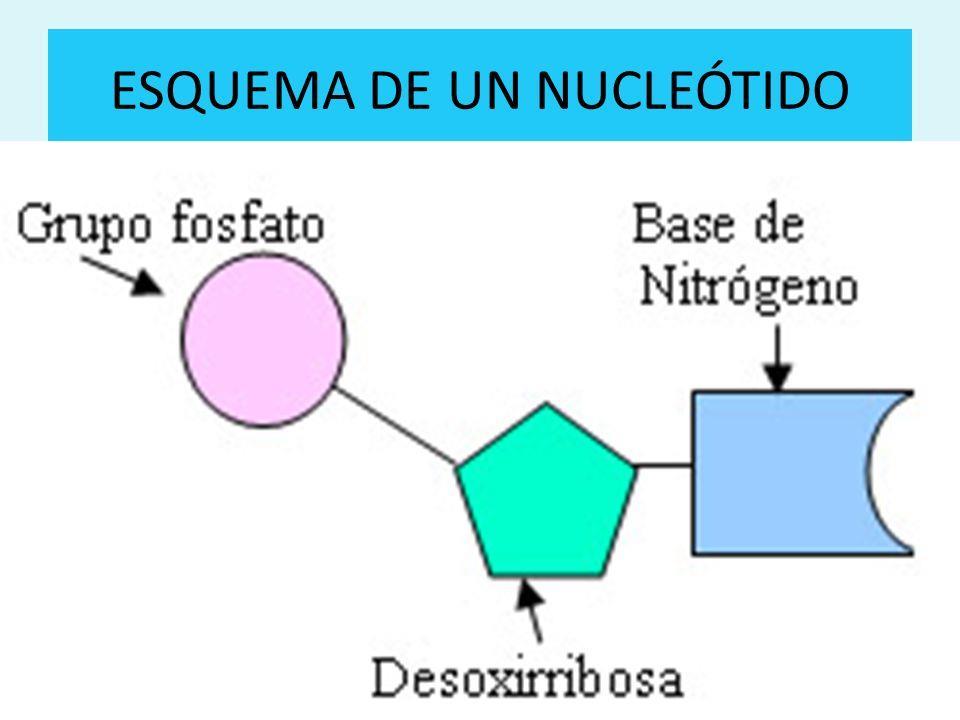


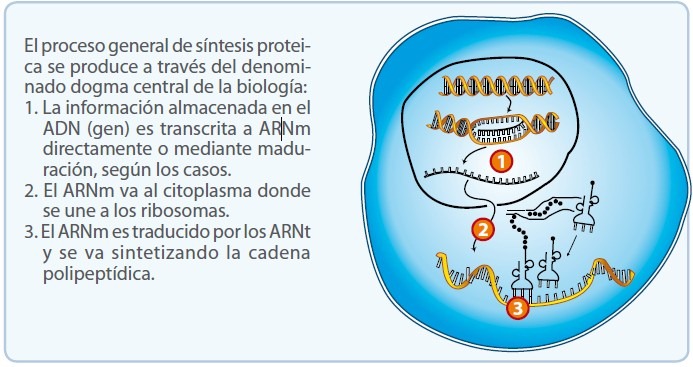




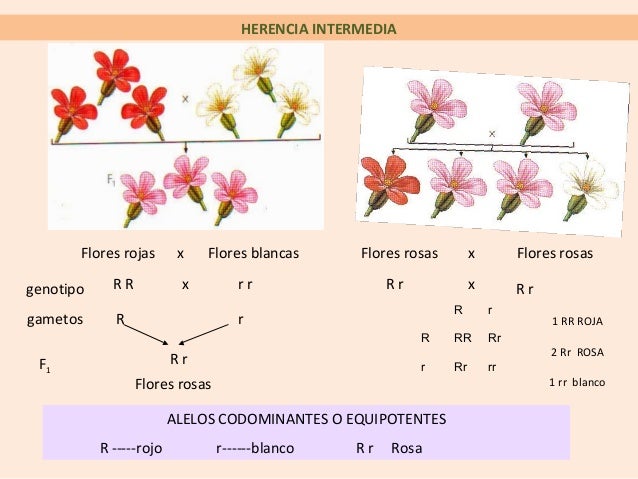


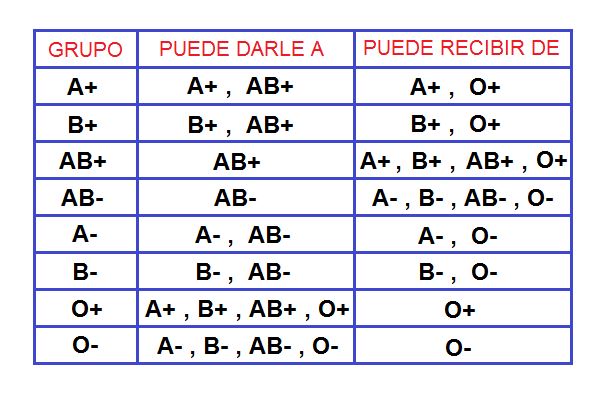










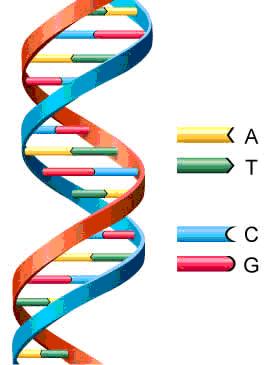
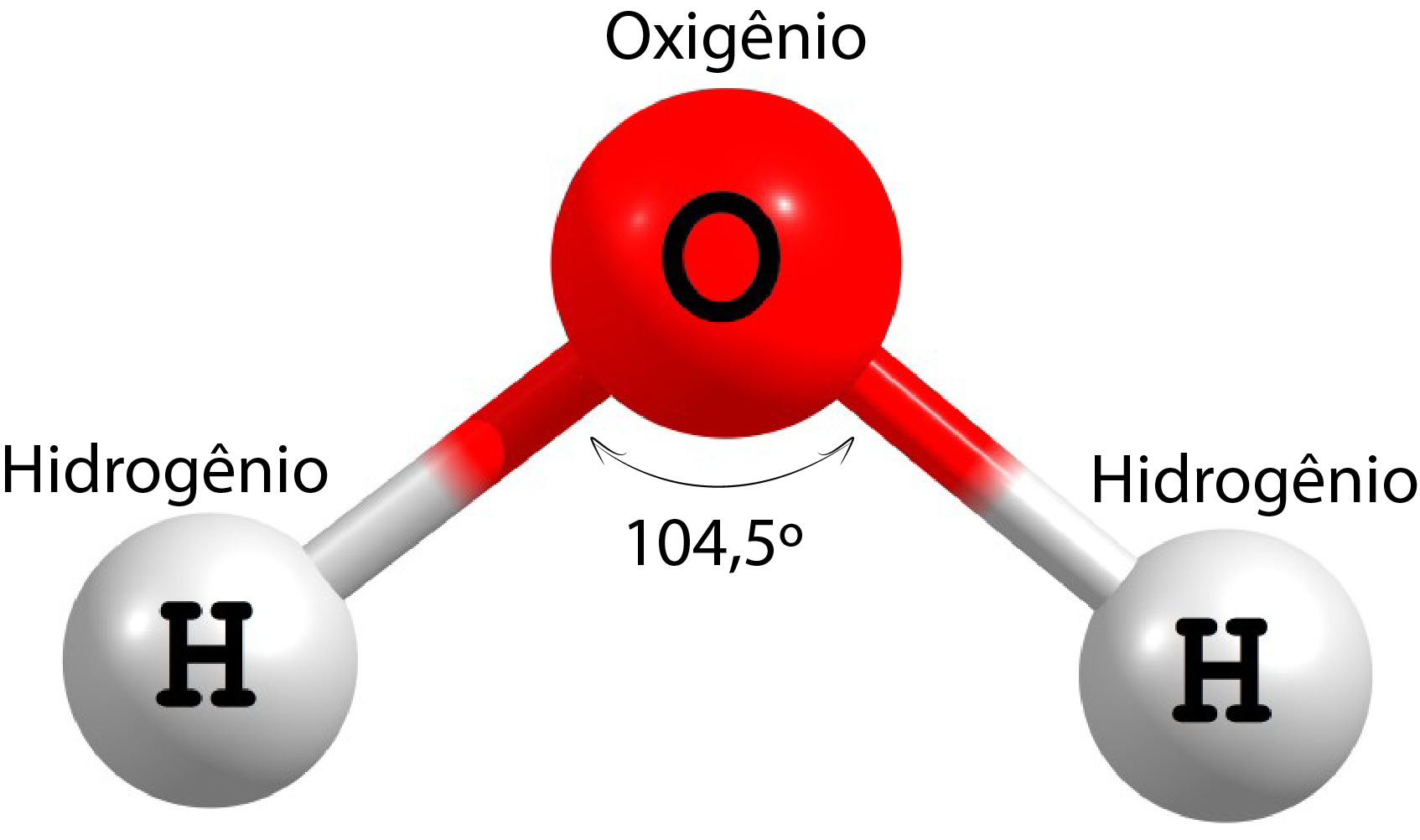




















hola profe, es para informale que los temas del 1 periodo no me aparecen en collage, entonces no se que temas son los que me faltan para realizar
ResponderEliminarEste comentario ha sido eliminado por el autor.
ResponderEliminaruy no profe eso esmucha tarea no he terminado la primera y ya pusola segunda :C
ResponderEliminary las respuestas??
ResponderEliminar